
【题目】下列离子方程式书写正确的是
A.Fe(OH)3 溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
B.K2S 溶液中加入AgCl 固体反应的离子方程式为:2AgCl+S2-===2Cl-+Ag2S
C.苯酚钠溶液中通入少量二氧化碳: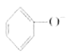 +CO2+H2O→
+CO2+H2O→![]() +CO32-
+CO32-
D.溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
【答案】B
【解析】
A.Fe(OH)3 溶于氢碘酸时,因为Fe3+具有氧化性,I-有还原性,所以二者还要发生氧化还原反应生成亚铁离子和碘离子,故A错误;
B.K2S 溶液中加入AgCl 固体,因为在相同条件下硫化银的溶解度小于氯化银的溶解度,所以氯化银可以转化成硫化银,故B正确;
C.因为酸性:碳酸>苯酚>碳酸氢根,所以苯酚钠溶液中通入少量二氧化碳时,只能生成碳酸氢钠,不能生成碳酸钠,故C错误;
D.因为氯气的氧化性强于铁离子和溴单质,所以过量的氯气可以将亚铁离子和溴离子全部氧化,而溴化亚铁中,亚铁离子与溴离子的比例关系为1:2,所以反应的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故D错误;
综上所述,答案为B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数)。请回答下列问题:
(1)下列关于烃A和烃B的说法不正确的是__填序号。
a.烃A和烃B可能互为同系物
b.烃A和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃
d.当n=11时,烃B可能的分子式有2种
(2)若烃A为链烃,且分子中所有碳原子都任同一条直线上,则A的结构简式为__。
(3)若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1molA最多可与1molH2加成,则A的名称是__。
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量的浓硫酸,浓硫酸的质量增加1.26g,再通过足量的碱石灰,碱石灰的质量增加4.4g,则烃B的分子式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,分别取10 mL pH均为2的盐酸、醋酸溶液分别与10mL 0.01 mol L-1 NaHCO3溶液混合,实验测得产生CO2气体的体积(V)随时间(t)的变化如图所示。下列说法不正确的是
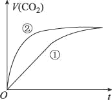
A.①表示的是盐酸的反应曲线
B.混合后的溶液中:c(CH3COO-)>c(C1-)
C.上述混合前三种溶液中水的电离程度:NaHCO3溶液>醋酸溶液=盐酸
D.醋酸和NaHCO3溶液混合后,所得的溶液中:c(CH3COO-)+ c(CH3COOH) = 0.005 mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中加入浓度均为0.2 mol·L1的CO和H2O, T℃发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
A.单位时间内消耗1 mol CO同时生成1 mol CO2
B.混合气体的密度不再变化
C.CO、H2O、CO2和H2 的浓度不再变化
D.混合气体的平均摩尔质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢氧燃料电池是符合绿色化学理念的新型发电装置,如图1为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
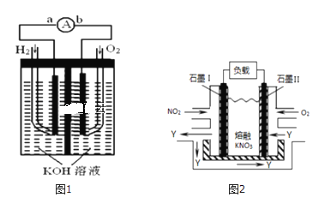
(1)负极反应式为______.
(2)电极表面镀铂粉的原因为______.
II.分析下列电解过程:
(1)写出惰性电极电解CuSO4溶液的总反应的离子方程式:______;
(2)写出惰性电极电解NaCl溶液的阳极反应式______;电解一段时间后加______(填物质名称)恢复电解前状况.
III.NO2、O2和熔融KNO3可制作燃料电池,其原理如图2
(1)请写出负极的电极方程式:______.
(2)相同条件下,放电过程中消耗的NO2和O2的体积比为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钨广泛用于冶金、机械、建筑、电子等领域。以黑钨精矿为原料冶炼钨的流程如图所示:
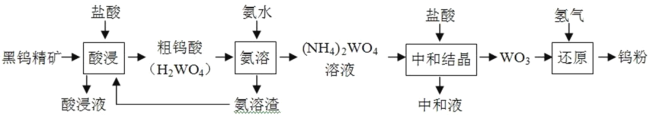
请回答下列问题。
(1)“酸浸液”中含有 Fe3+、Fe2+等金属离子,检验其中的 Fe2+常使用铁氰化钾溶液,反应的离子方程式 为_____。
(2)“氨溶”时需加热,但应控制温度不超过 70℃的原因为_____。
(3)“中和结晶”时(NH4)2WO4 与盐酸反应生成 WO3 的化学方程式为_____,所得“中和 液”的主要溶质的电子式为_____。
(4)流程图中设计将“氨溶渣”返回“酸浸”过程的目的为__________。
(5)钨钛合金在工业中应用广泛, NH4Fe(SO4)2 滴定法可测定合金中钛的含量:称取 w g 钨钛合金,用 HNO3-HF混合液溶解,用 NaOH 溶液沉淀并分离钛元素后加盐酸溶解,用金属铝将 Ti4+还原为 Ti3+,向溶液中加几滴 KSCN 作指示剂,用 c mol/L 的 NH4Fe(SO4)2 标准溶液滴定至溶液显红色,消耗标准溶液的体积为 V mL。
①滴定时发生反应的离子方程式是_____;
②样品中钛的含量为_____%(用含 w、c、V 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1mol·L-1氨水中滴入0.1mol·L-1盐酸,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加盐酸体积的关系如图所示,下列说法不正确的是( )
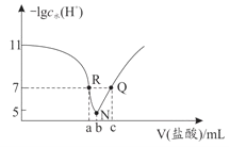
A.常温下,Kb(NH3·H2O)约为1×10-5
B.b=20.00
C.R、Q两点对应溶液均呈中性
D.R到N、N到Q所加盐酸体积不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com