
【题目】下列表示反应 NaHSO4+NaHCO3=Na2SO4 + H2O十CO2↑中相关微粒的化学用语不正确的是
A.CO2的结构式: O=C= O
B.H2O的电子式:![]()
C.Na+的结构示意图:![]()
D.水溶液中,NaHCO3的电离方程式: NaHCO3=Na+ + H+ + CO![]()
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(s)的能量变化如图所示,判断下列叙述中错误的是( )
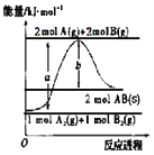
A.该反应热△H=+(a﹣b)kJmol﹣1
B.AB(g)═A2(g)+B2(g)△H=+b/2kJmol﹣1
C.断裂1 mol A﹣A键和1 mol B﹣B键,吸收a kJ能量
D.该反应在任何条件下都不可能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值.下列说法正确的是( )
A.46g乙醇中存在的共价键总数为7NA
B.HNO3作为氧化剂得到的电子数一定为3NA
C.1mol甲醇完全燃烧时,转移的电子数为6NA
D.将3.4g H2S全部溶于水,所得溶液中HS-和S2-离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法错误的是( )
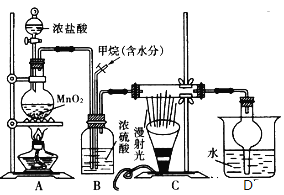
A.实验时先点燃A处酒精灯再通甲烷
B.装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C.从D中分离出盐酸的方法为过滤
D.装置C经过一段时间的强光照射后,生成的有机物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知工业上常用“有效氢含量”衡量含氢还原剂的还原能力,其定义为 :每克含氢还原剂的还原能力相当于多少克H2的还原能力。硼氢化钠(NaBH4)是一种极强的含氢还原剂,下列有关说法正确的是
A.NaBH4作还原剂时 ,其中的硼元素被氧化
B.NaBH4 的“有效氢含量”约为0.21
C.反应8Au3+ +BH![]() +OH-→ 8Au+BO
+OH-→ 8Au+BO![]() +H2O中水的化学计量数为16
+H2O中水的化学计量数为16
D.NaBH4遇水产生大量的氧气可作供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。某同学以含铜废料(主要成分是 CuO、MgO、MnO、SiO2及少量的杂质)为主要原料制备CuCl的主要流程如下:
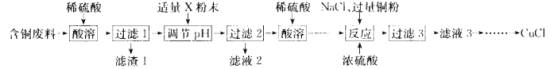
已知:①CuCl难溶于水和乙醇 ,在潮湿的空气中易被氧化;
②在水溶液中存在平衡 :CuCl(白色)+2Cl-![]() [CuCl3]2-(色无溶液)。
[CuCl3]2-(色无溶液)。
③几种金属氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | 开始沉淀的 pH | 完全沉淀的 pH |
Mg(OH)2 | 8. 4 | 10. 8 |
Cu(OH)2 | 4.2 | 6. 7 |
Mn(OH)2 | 7. 8 | 8. 8 |
问答下列问题:
(1)滤渣1 的主要成分是 _________________(写化学式,下同)。
(2)“调pH”所用粉末状试剂 X 是_____________;pH的调节范闱为____________。
(3)“反应”发生 Cu2+ +Cu+6Cl-=2[CuCl3]2-,表明已完全反应的现象是_______________。
(4)向“滤液3” 加大量的水,过滤可得 CuCl。所得沉淀需再用乙醇洗涤.并在低温下干燥,其原因是___________。
(5)产品纯度的测定,步骤如下:称取mg试样置于锥形瓶中,加入直径 4 ~ 5 mm 玻璃珠适量,并加入 10 mL FeCl3溶液,摇动至样品全部溶解后(CuCl+FeCl3=CuCl2+FeCl2),再加入50 mL,水和2滴邻菲罗啉指示剂,立刻用c mol L-1 的硫酸高铈[Ce(SO4)2]标准溶液滴定(Fe2++Ce4+=Fe3++Ce3+)'滴至终点时共消耗硫酸高铈标准溶液V mL。
①锥形瓶中加入玻璃珠的作用是____________________。
②样品中 CuCl 的质量分数为_____(列出表达式即可 , 用含(c、m、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下两个容积相等的储气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶气体一定具有相同的( )
A.质量B.密度C.碳原子数D.原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PMMA骨水泥的成分为聚甲基丙烯酸甲酯,结构简式为 ,其单体丙的制备原理如图所示,下列说法中错误的是
,其单体丙的制备原理如图所示,下列说法中错误的是

A.丙所含的官能团有碳碳双键、酯基
B.可以用饱和碳酸氢钠溶液鉴别甲、乙、丙
C.丙与聚甲基丙烯酸甲酯互为同系物
D.甲+乙→丙的反应类型为取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com