
����Ŀ��SF6��������ѹ�����豸�еġ������Ե���ء�����S(g)��F2(g)�Ʊ�SF6(g)�������仯��ͼ��ʾ������˵����ȷ����
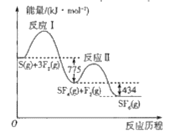
A.����֪S��F���ļ������ȷ��F��F���ļ���
B.S(g)��3F2(g)=SF6(g)��H=��1209kJ��mol��1
C.��S(g)��3F2(g)=SF6(g)��ȣ�S(s)��3F2(g)=SF6(g)�ų��������϶�
D.���ڷ�Ӧ��ų����������ڷ�Ӧ�����Է�Ӧ���ʣ���>��
���𰸡�A
��������
A�����ݵڶ����ķ�Ӧ�ȿ��Եó���![]() ��������֪S��F���ļ������ȷ��F��F���ļ��ܣ�A��ȷ��
��������֪S��F���ļ������ȷ��F��F���ļ��ܣ�A��ȷ��
B����ͼ�п�֪�÷�ӦΪ���ȷ�Ӧ��S(g)��3F2(g)=SF6(g)��H=-1209kJ��mol��1��B����
C����S(g)��S(s)�Ĺ����Ƿ��ȵģ�����S(g)��3F2(g)=SF6(g)��ȣ�S(s)��3F2(g)=SF6(g)�ų����������٣�C����
D�����ڷ�Ӧ���ų����������ڷ�Ӧ�������Ƿ�Ӧ�����뷴Ӧ�ȵĴ�С�أ����뷴Ӧ�Ļ���йأ�һ����ԽС��Ӧ����Խ�죬�ʷ�Ӧ����Ӧ������<����D����
�ʴ�Ϊ��A��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����ȿ���CO��CO2��Ӧ�þ�����Ҫ��������塣�ش��������⣺
��1��CO�����ڸ�¯��������֪��
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2 (g) ��H1= a kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2 (g) �� H2= b kJ/mol
��ӦFe2O3(s)+3CO(g)=2Fe(s)+3CO2 (g)����H=________kJ/mol
��2��ij�¶��£����ݻ�Ϊ2 L���ܱ���������Ͷ��8molCO2(g)��16molH2(g)������Ӧ��
CO2 (g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
������15 min��ﵽƽ�⣬��ʱCO2��ת����Ϊ75%����015 min���ö�����̼��ʾƽ����Ӧ����v��CO2��=_______������������¸÷�Ӧ��ƽ�ⳣ��K= __________��
��3����̼������ָ�ӿ����в��������̼�ĸ��ֿ�ѧ������ͳ�ơ�ĿǰNH3��(NH4)2CO3�������Ѿ���������ҵ��̼����
�����������в�������ΪCO2���������___________��
A��Na2CO3 B��NaOH C��CH3CH2OH D��NH4Cl
����(NH4)2CO3��̼�ķ�Ӧ��(NH4)2CO3(aq)��H2O(l)��CO2(g) ![]() 2NH4HCO3(aq)��Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��һ������(NH4)2CO3��Һ�����ܱ������У�������һ������CO2���壬����������ʼʵ���������䣬�ֱ��ڲ�ͬ�¶��£�������ͬʱ����CO2����Ũ�ȣ��õ�����ͼ��
2NH4HCO3(aq)��Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��һ������(NH4)2CO3��Һ�����ܱ������У�������һ������CO2���壬����������ʼʵ���������䣬�ֱ��ڲ�ͬ�¶��£�������ͬʱ����CO2����Ũ�ȣ��õ�����ͼ��
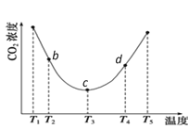
I. c����淴Ӧ���ʺ�d�������Ӧ���ʵĴ�С��ϵΪ
����c _____����d (������������������������)
II. b��c��d�����ƽ�ⳣ��K b ��K c�� Kd �Ӵ�С��˳��Ϊ_______��(������������������������)
III��T3��T4�¶����䣬������CO2����Ũ�ȳ�������ı仯���ƣ���ԭ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ����Χ��Ũ����Ļ�ѧ���ʽ���������ʵ��̽���������������Ƿ����ձ��У����뼸��ˮ��������ȣ�Ȼ�����Ũ���ᣬ���ɺ�ɫ���ʡ�
��ش��������⣺
��1�����ɵĺ�ɫ����(����)��_____(�ѧʽ)��
��2�����ֺ�ɫ���ʼ�����Ũ�������û�����������壬����һ�������д̼�����ζ���Ǵ�������Ҫ��Ⱦ��֮һ�����ִ̼�����ζ������ɷ���_______(�ѧʽ)����Ӧ�Ļ�ѧ����ʽΪ_________��
��3����������Ũ���ᷴӦ��ʵ������˵��Ũ�������___________(�����)��
A������ | B����ˮ�� | C����ˮ�� | D��ǿ������ |
��4������2���в������д̼�����ζ������ͨ��Ʒ����Һ�У����Կ���Ʒ����Һ_______��˵�������������_______�ԣ�����2���в������д̼�����ζ������ͨ��ˮ�п�����һ�ֲ��ȶ����ֽ���ᣬ��д���÷�Ӧ�Ļ�ѧ����ʽ��__________________________________________��
��5���ܷ��ó���ʯ��ˮ�������������壿_______(������������������)�������ܣ�����д�����ܼ�����Լ�____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y��Z��W��ԭ��������������Xԭ�ӵ������������Ǵ�����3��������Ԫ��Yԭ�Ӻ�����δ�ɶԵ��ӣ� Z�ĵ��ʾ�����Ӧ����㷺�İ뵼����ϣ�W��Xλ��ͬһ���塣����˵������ȷ����
A.W������������Ӧ��ˮ������ǿ��
B.X�ļ���̬�⻯��ķе��W�ĸ�
C.Y�ĵ�һ�����ܱ�ͬ��������Ԫ�صĴ�
D.1mol����Z�й��ۼ�����ĿԼΪ4��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���к���CO��NOx����Ⱦ���������β����Ⱦ����Ҫ�о����⡣
(1)��֪�� N2(g) + O2(g)==2NO(g) ��H=+ 180.5kJ��mol-1
2C(s)+ O2(g)== 2CO(g) ��H= - 221.0kJ��mol-1
C(s)+ O2(g)==CO2(g) ��H= -393.5 kJ��mol-1
2CO(g)+ 2NO(g)== N2(g)+ 2CO2(g) ��H=_______kJ��mol-1
(2)ij�¶��£�Ϊ̽��2CO(g)+ 2NO(g)N2(g)+ 2CO2(g)�ķ�Ӧ���ʣ������崫������ò�ͬʱ���CO��NOŨ�����±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO)/10-4mol��L-1 | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
c(NO)/10-4mol��L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
��ǰ2s�ڣ�������Ӧ��ƽ����Ӧ����v(NO)=_______��
�ڸ��¶��£�������Ӧ��ƽ�ⳣ��K=_________��
�۶���������Ӧ������������ȷ����________(����ĸ)��
A.��Ӧ�ڵ��������Է����� B.��2v��(CO)=v��(N2)ʱ����Ӧ�ﵽƽ��״̬
C.�о���Ӧ�ĸ�Ч���������ش� D.��Ӧ�ﵽƽ��ʱ��CO��NO��ת�������
(3)COŨ�ȷ�������ȼ�ϵ��Ϊ����ԭ������װ����ͼ��ʾ���õ���е����Ϊ������-�����ƣ�����O2-�����ڹ������NASICON�������ƶ���д����缫a�ĵ缫��Ӧʽ��_________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵĹ�ҵ�Ʊ�������������
A.��������ȡ�⣺�����ҽ�ȡҺ![]() ��
��![]() �ľƾ���Һ
�ľƾ���Һ![]() �ⵥ��
�ⵥ��
B.����������![]()
C.��ˮ��þ��![]()
D.������������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʻ���(COS)�ڳ��³�ѹ��Ϊ�г�������ζ����ɫ���壬�㷺Ӧ����ũҩ��ҽҩ���������������У�������ú��ʯ�ͺ���Ȼ���е��ʻ���ḯʴ�豸����Ⱦ����������Σ�����彡������ҵ�ϴ����ʻ����ķ�����ˮ�ⷴӦ����ⷴӦ��
(1)��֪�ʻ���������ԭ���������ﵽ8���ӽṹ������ṹʽΪ________________��
(2)����֪��H2(g)��COS(g)![]() H2S(g)��CO(g)��H1=��6.2kJ��mol��1��
H2S(g)��CO(g)��H1=��6.2kJ��mol��1��
��H2(g)��CO2(g)![]() H2O(g)��CO(g)��H2=��41.2kJ��mol��1��
H2O(g)��CO(g)��H2=��41.2kJ��mol��1��
��COSˮ�ⷴӦ���Ȼ�ѧ����ʽΪH2O(g)��COS(g)=H2S(g)��CO2(g)����H=___________kJ/mol.
����֪��COSˮ�ⷴӦ�Ļ������£����������ڴ��������������*��ע��
a. ������H2O��H2O*
b. ��Ӧ��COS��H2O*��CO2��H2S*
c. �Ѹ���H2S*��H2S
��֪COSˮ�ⷴӦ�ķ�Ӧ������b��������a��b��c�����л��������__________________��
(3)��֪COS��ⷴӦ���Ȼ�ѧ����ʽΪH2(g)��COS(g)![]() H2S(g)��CO(g) ��H=+6.2kJ��mol��1��һ���¶��£���ij�����ܱ������г���4molCOS(g)��6molH2(g)������ⷴӦ��H2��COS���������
H2S(g)��CO(g) ��H=+6.2kJ��mol��1��һ���¶��£���ij�����ܱ������г���4molCOS(g)��6molH2(g)������ⷴӦ��H2��COS���������![]() ��ʱ��仯�Ĺ�ϵ��ͼ��ʾ��
��ʱ��仯�Ĺ�ϵ��ͼ��ʾ��
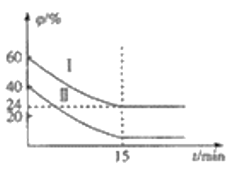
��H2��ƽ��ת����Ϊ_________________��
�ڸ��¶��£���Ӧ��ƽ�ⳣ��KΪ__________________��
�������������䣬20minʱ����������г���2molH2��3molCO����ʱv(��)______________v(��)(������������С��������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�������װ�õ���������ȷ����(����)
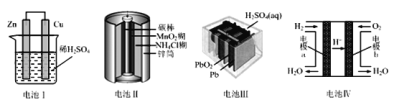
A.����������������ķ�ӦΪ2H++2e���TH2��
B.�������пͲ������������������Ӧ
C.�������������ʹ�õij���أ��ֳ�Ϊ���ε��
D.����������·�е����ɵ缫bͨ����������缫a
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com