
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是__。
SO2压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是__(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2molSO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
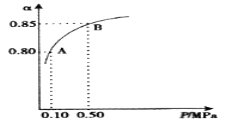
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0molSO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。平衡状态由A变到B时,平衡常数K(A)__K(B)(填“>”、“<”或“=”),B点的化学平衡常数是__。
(4)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,t1时刻达到平衡,测得容器中含SO30.18mol。
①tl时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是__。
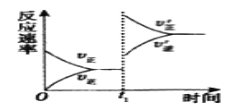
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20molSO2和0.10molO2,则平衡__移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,_mol<n(SO3)<_mol。
【答案】1个大气压和400℃ A、C = 800 C 正向 0.36 0.4
【解析】
(1)从表中可以看出,压强越大,SO2的转化率越大,但变化不大;温度越高,转化率越小。综合以上分析,应选择低温低压。
(2)A.保持温度和容器体积不变,充入1molO2(g),平衡正向移动,SO2(g)平衡浓度减小;
B.保持温度和容器体积不变,充入2molSO3(g),平衡逆向移动,SO2(g)平衡浓度增大;
C.降低温度,平衡正向移动,SO2(g)平衡浓度减小;
D.在其他条件不变时,减小容器的容积,相当于加压,平衡正向移动,SO2(g)平衡浓度增大。
(3)温度一定时,平衡常数不变,由此得出A、B两点平衡常数K(A)与K(B)的关系,因为给定压强为0.10MPa,是A点的压强,所以应用A点的转化率计算化学平衡常数。
(4)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,t1时刻达到平衡,测得容器中含SO30.18mol。
①A.体积不变,向容器中通入少量O2,v正增大,v逆不变;
B.体积不变,向容器中通入少量SO2,v正增大,v逆不变;
C.缩小容器体积,相当于加压,平衡正向移动,v正增大,v逆增大,但v正增大更多;
D.升高温度,平衡逆向移动,v正增大,v逆增大,但 v逆增大更多;
E.体积不变,向容器中通入少量氮气,平衡不发生移动,v正不变,v逆不变。
②若继续通入0.20molSO2和0.10molO2,相当于加压,平衡正向移动,再次达到平衡后,n(SO3)应比原平衡时浓度的二倍要大,但比反应物完全转化要小。
(1)从表中可以看出,压强越大,SO2的转化率越大,但变化不大;温度越高,转化率越小。综合以上分析,应选择低温低压,故应选择1个大气压和400℃。答案为:1个大气压和400℃;
(2)A.保持温度和容器体积不变,充入1molO2(g),平衡正向移动,SO2(g)平衡浓度减小,A符合题意;
B.保持温度和容器体积不变,充入2molSO3(g),平衡逆向移动,SO2(g)平衡浓度增大,B不合题意;
C.降低温度,平衡正向移动,SO2(g)平衡浓度减小,C符合题意;
D.在其他条件不变时,减小容器的容积,相当于加压,虽然平衡正向移动,但SO2(g)平衡浓度仍比原平衡时大,D不合题意;
故选AC;
(3)温度一定时,平衡常数不变,由此得出A、B两点平衡常数K(A)=K(B),因为给定压强为0.10MPa,是A点的压强,所以应用A点的转化率计算化学平衡常数,从而建立以下三段式:

K=![]() =800。答案为:=;800;
=800。答案为:=;800;
(4)①A.体积不变,向容器中通入少量O2,v正增大,v逆不变,A不合题意;
B.体积不变,向容器中通入少量SO2,v正增大,v逆不变,B不合题意;
C.缩小容器体积,相当于加压,平衡正向移动,v正增大,v逆增大,但v正增大更多,C符合题意;
D.升高温度,平衡逆向移动,v正增大,v逆增大,但 v逆增大更多,D不合题意;
E.体积不变,向容器中通入少量氮气,平衡不发生移动,v正不变,v逆不变,E不合题意;
故选C;
②若继续通入0.20molSO2和0.10molO2,相当于加压,平衡正向移动,再次达到平衡后,n(SO3)应比原平衡时浓度的二倍要大,即n(SO3)>0.36mol,但比反应物完全转化要小,即n(SO3)<0.4mol。答案为:正向;0.36mol;0.4mol。


科目:高中化学 来源: 题型:
【题目】用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
A.砷原子的结构示意图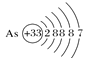 B.BF4—的结构式
B.BF4—的结构式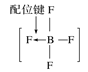
C.HF分子间的氢键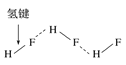 D.丙氨酸的手性异构
D.丙氨酸的手性异构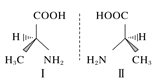
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:____。
(2)实验②的化学反应中转移电子的物质的量是____。
Ⅱ.(3)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1mol O3转化为1mol O2和1mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是____(填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.醋酸溶解水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
B.向氨水中通入过量SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
C.用石墨作电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对X+Y![]() 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
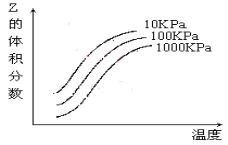
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】任意两个环共用两个不直接相连的碳原子的有机化合物称为桥环化合物,二环[1,1,0]丁烷(![]() )是最简单的桥环化合物。下列有关该化合物的叙述不正确的是( )
)是最简单的桥环化合物。下列有关该化合物的叙述不正确的是( )
A.与1,3-丁二烯互为同分异构体
B.其二氯代物有3种(不考虑立体异构)
C.4个碳原子不在同一个平面
D.1mol该物质完全燃烧时最多消耗5.5molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A.苯和乙苯 B.12C60和石墨 C.![]() 和
和![]() D.35Cl和37Cl E.乙酸和乙二酸
D.35Cl和37Cl E.乙酸和乙二酸
(1)互为同位素的是___;
(2)互为同系物的是___;
(3)互为同素异形体的是__;
(4)互为同分异构体的是___;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种植物生长调节剂的分子结构如下图所示。下列说法不正确的是( )
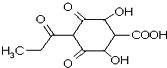
A.该物质含有 3 种官能团
B.该物质属于多官能团化合物
C.该物质属于烃的衍生物
D.该物质属于芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
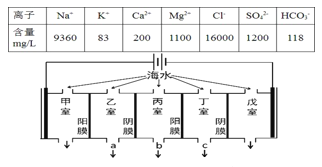
A.甲室的电极反应式为:2Cl--2e-=Cl2↑
B.淡化过程中易在戊室形成水垢
C.乙室和丁室中部分离子的浓度增大,淡水的出口为b
D.通过甲室阳膜的离子的物质的量为2mol时,戊室收集到22.4L(标准状况下)气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com