
【题目】如图是温度和压强对X+Y![]() 2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
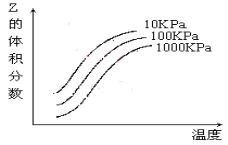
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
科目:高中化学 来源: 题型:
【题目】某小组模拟工业上回收分银渣中的银,过程如下:

(1)Na2SO3溶液和氨水均可作浸出剂,但由于氨水易______(填物理性质),故用Na2SO3溶液更环保。
(2)Ⅰ中主要反应:AgCl + 2![]()
![]()
![]() + Cl-。研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是______(用离子方程式表示)。
+ Cl-。研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是______(用离子方程式表示)。
(3)研究发现:浸出液中含银化合物总浓度与含硫化合物总浓度及浸出液pH的关系如下图。

①pH=10时,含银化合物总浓度随含硫化合物总浓度的变化趋势是______。
②解释①中变化趋势的原因:______。
③pH=5时,含银化合物总浓度随含硫化合物总浓度的变化与pH=10时不同,原因是___。
(4)将Ⅱ中反应的离子方程式补充完整:
□__![]() +□___OH- +□______ = □______ +□______ +□______ + CO32-
+□___OH- +□______ = □______ +□______ +□______ + CO32-
(5)Ⅲ中回收液可直接循环使用,但循环多次后,银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象在有机物中广泛存在,如图为苯及其几种同分异构体的键线式,下列有关说法中正确的是

A. b、c均与乙烯互为同系物
B. a和d的二氯代物均有3种
C. 4种有机物均能使酸性高锰酸钾溶液褪色
D. a和b中所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硝酸的说法中正确的是( )
A.硝酸电离出的H+,能被Zn还原成H2
B.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
C.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,可在管口观察到红棕色气体
D.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
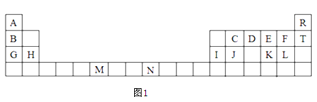
试回答下列问题:
(1)F-的结构示意图:__。
(2)D的气态氢化物的VSEPR模型为___,其中心原子的杂化类型为___,分子的空间构型为___。
(3)G、H和I的第一电离能数值由大到小的顺序为:___(用元素符号作答)。
(4)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有____(填元素符号)。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是___(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___(填分子式)。
(5)已知元素N可形成一种红紫色配合物,其组成为NCl3·5NH3·H2O。该配合物中的中心离子N离子在基态时核外简化电子排布式为___,又已知中心离子N离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质的配体是___。
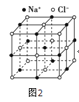
(6)过去常以JE2为催化剂的载体。JE2的晶胞可作如下推导:先将NaCl晶胞中的所有Na+去掉,并将Cl-全部换成J原子,再在每两个不共面的“小立方体”中心处各放置一个J原子便构成了晶体J的一个晶胞,则一个J的晶胞中有___个J原子,再在每两个相邻的J原子(距离最近的两个J原子)中心连线的中点处增添一个E原子,便构成了JE2晶胞,故JE2晶胞中有___个E原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( )

A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡
B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
C.d点对应溶液中:c(OH-)-c(H+)=c(A-)
D.a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物甲与乙在一定条件下可反应生成丙:
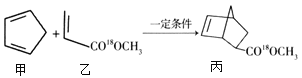
下列说法正确的是
A. 甲与乙生成丙的反应属于取代反应
B. 甲分子中所有原子共平面
C. 乙的一氯代物有2种
D. 丙在酸性条件下水解生成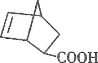 和CH318OH
和CH318OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫分子(SO2)分子中共有__个σ键,其中心原子(硫原子)的孤电子对数为__;价层电子对数为__,该分子的VSEPR模型为__;则该分子呈__形,二氧化硫分子的中心原子的杂化类型为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的是( )

A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com