
【题目】磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
物质 | H3PO4 | HF |
电离常数 | Ka1=7.1×103; Ka2=6.3×108; Ka3=4.2×1013 | Ka=6.6×104 |
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为____________
(2)已知:
Ⅰ.CaO(s)+H2SO4(l)![]() CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
CaSO4(s)+H2O(l) ΔH=-271kJ·mol1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)![]() Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol1
则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为____________。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率________(填“增大”“减小”或“不变”,下同);HF的平衡浓度________。
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH。
CO2(g)+H2(g) ΔH。
①一定温度下,向10L密闭容器中充入0.5mol CO和1mol H2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L1·min1。则CO的平衡转化率α=________;该反应的平衡常数K=________。
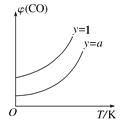
②在压强不变的密闭容器中发生上述反应,设起始的![]() =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由为_____________
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a_____1,理由为_____________
【答案】H3PO4+F-=HF+H2PO4- Ca5(PO4)3F(s)+5H2SO4(l)![]() 3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1 增大 不变 80%
3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1 增大 不变 80% ![]() < < 相同温度下,y越小,CO的转化率越大,其平衡体积分数越小
< < 相同温度下,y越小,CO的转化率越大,其平衡体积分数越小
【解析】
(1)根据电离平衡常数可知酸性有如下关系:H3PO4>HF>H2PO4->HPO42-,所以向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为为:H3PO4+F-=HF+H2PO4-;
(2)①已知:Ⅰ.CaO(s)+H2SO4(l)![]() CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1
CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)![]() Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ·mol-1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937 kJ·mol-1
根据盖斯定律可知Ⅰ×5-Ⅱ即得到Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为Ca5(PO4)3F(s)+5H2SO4(l)![]() 3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1;
3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418 kJ·mol-1;
②反应Ⅱ的正反应体积减小,所以达到平衡后缩小容器容积平衡向正反应方向移动,HF的平衡转化率增大。由于温度不变,平衡常数不变,即K=c(HF),因此HF的平衡浓度不变;
(3)①测得 0~2 min内用CO2表示的反应速率v(CO2)=0.02 mol·L-1·min-1,所以生成CO2浓度是0.04mol/L,则

因此CO的平衡转化率α=![]() ×100%=80%,该反应的平衡常数K=
×100%=80%,该反应的平衡常数K=![]() =
=![]() ;
;
②根据图像可知升高温度CO的体积分数增大,说明平衡向逆反应方向进行,所以该反应的ΔH<0,由于相同温度下,y越小,CO的转化率越大,其平衡体积分数越小,所以a<1。


科目:高中化学 来源: 题型:
【题目】氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( )
A. 平面三角形 sp2杂化B. V形 sp2杂化
C. 三角锥形 sp3杂化D. 直线形 sp杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷烃A只能形成三种一氯取代产物B、C和D。反应过程如下:
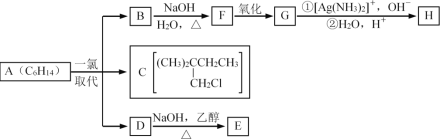
请回答下列问题:
(1)A的系统名称是_______,H的结构简式为_______。
(2)B转化为F属于_______反应,D转化为E的反应属于_______反应。
(3)写出F转化为G的化学方程式:_______。
(4)和F具有相同官能团的F的同分异构体的种类有_______种。(不包括F)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用O2氧化NH3制备硝酸的装置如图所示(夹持装置略),下列说法不正确的是

A.球形干燥管B中可以填充碱石灰或五氧化二磷
B.实验过程中,若熄灭酒精灯,装置C中的氧化铬继续保持红热,说明装置C中的反应放热
C.球形干燥管D中的无水氯化钙可吸收尾气中的氨气和水蒸气
D.装置E中的石蕊试液最终变红,说明锥形瓶中有硝酸产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是广泛存在于植物中的一类芳香化合物,大多具有光敏性,有的还具有抗菌和消炎作用。它的核心结构是芳香内酯A,其分子式为C9H6O2,该芳香内酯A经下列步骤转变为水杨酸和化合物E。

已知:CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)A中官能团的名称为__________;化合物C的结构简式为__________。
(2)B生成C的反应类型为__________,化合物E的化学名称是__________。
(3)写出A→B的化学方程式:__________
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的二元取代物,且水解后生成的产物之一能发生银镜反应,这类同分异构体共有__________种;写出其中核磁共振氢谱有5组峰,且峰面积之比为1:1:2:2:2的同分异构体的结构简式:__________。
(5)已知:R-CH=CH2![]() R-CH2CH2Br,请设计合理方案由
R-CH2CH2Br,请设计合理方案由 合成
合成 (其他无机原料自选,用反应流程图表示,并注明反应条件)___________________________。
(其他无机原料自选,用反应流程图表示,并注明反应条件)___________________________。
示例:原料![]() 产物
产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使甲基橙变黄色的溶液中:Na+、Al3+、![]() 、Cl-
、Cl-
B.0.1mol/L的烧碱溶液中:K+、Ba2+、Cl-、HCO3-
C.![]() =1×10-13 mol·L-1的溶液中:
=1×10-13 mol·L-1的溶液中:![]() 、Ca2+、Cl-、
、Ca2+、Cl-、![]()
D.水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盛有10mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后还剩余4mL无色气体,则剩余气体可能为( )
A.NO和O2B.NO或O2C.NOD.O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
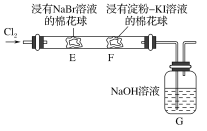
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH-+Cl2===ClO-+Cl-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com