
 (1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、 (PAN)等二次污染物.
(PAN)等二次污染物.分析 (1)①一个单键就是一个σ键,一个双键中含有一个σ键,一个π键;根据元素周期律,以及第ⅤA族比同周期的ⅥA族第一电离能高,可知N、O、C、H的第一电离能依次减小,据此答题;
②配位体位于方括号中,由1个NO和5个H20分子构成;中心离子为Fe2+,铁是26号元素,所以Fe2+的电子排布式为1s22s22p63s23p63d6,据此答题;
③HCOOH分子间能形成氢键,CH30CH3不能形成分子间氢键,据此答题;
(2)①(NH4)2SO4晶体中铵根离子和硫酸根离子之间是离子键,而铵根离子和硫酸根离子内部都是共价键,据此答题;
②NH4+的中心原子氮原子价层电子对数=$\frac{5+4-1}{2}$=4,孤电子对=$\frac{5-1×4-1}{2}$=0,NO3-的中心原子氮原子价层电子对数=$\frac{5+1}{2}$=3,据此判断;
(3)氯气将+2价的铁氧化成+3价的铁,根据电子得失守恒书写化学方程式;
(4)以亚铁离子为中心,沿X、Y、Z三轴进行切割,从而确定亚铁离子配位数,根据均摊法可知,晶胞中含有亚铁离子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,氧离子数为12×$\frac{1}{4}$+1=4,晶胞边长为acm,所以晶胞体积为(acm)3,根据$ρ=\frac{m}{V}$计算.
解答 解:(1)①一个单键就是一个σ键,一个双键中含有一个σ键,一个π键, 中共有11个共价键,所以1mol PAN中含有的σ键数目为10mol;根据元素周期律,以及第ⅤA族比同周期的ⅥA族第一电离能高,可知N、O、C、H的第一电离能依次减小,
中共有11个共价键,所以1mol PAN中含有的σ键数目为10mol;根据元素周期律,以及第ⅤA族比同周期的ⅥA族第一电离能高,可知N、O、C、H的第一电离能依次减小,
故答案为:10NA(或10×6.02×1023);N>O>C>H;
②配位体位于方括号中,由1个NO和5个H20分子构成;中心离子为Fe2+,铁是26号元素,所以Fe2+的电子排布式为1s22s22p63s23p63d6,
故答案为:6;1s22s22p63s23p63d6(或[Ar]3d6);
③HCOOH分子间能形成氢键,CH30CH3不能形成分子间氢键,所以相同压强下,HCOOH的沸点比CH3OCH3高,
故答案为:高;HCOOH分子间能形成氢键;
(2)①(NH4)2SO4晶体中铵根离子和硫酸根离子之间是离子键,而铵根离子和硫酸根离子内部都是共价键,其中铵根离子内部含一个配位键,故答案为:de;
②NH4+的中心原子氮原子价层电子对数=$\frac{5+4-1}{2}$=4,孤电子对=$\frac{5-1×4-1}{2}$=0,NO3-的中心原子氮原子价层电子对数=$\frac{5+1}{2}$=3,所以氮原子按sp2 方式杂化,
故答案为:正四面体形;sp2;
(3)氯气将+2价的铁氧化成+3价的铁,所以反应方程式为:2K4[Fe(CN)6]+Cl2=2K3[Fe(CN)6]+2KCl,
故答案为:2K4[Fe(CN)6]+Cl2=2K3[Fe(CN)6]+2KCl;
(4)以亚铁离子为中心,沿X、Y、Z三轴进行切割,结合图片知,亚铁离子配位数为6,根据均摊法可知,晶胞中含有亚铁离子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,氧离子数为12×$\frac{1}{4}$+1=4,所以$ρ=\frac{m}{V}$=$\frac{\frac{4×(56+16)}{{N}_{A}}}{{a}^{3}}$g/cm3=$\frac{288}{{a}^{3}{N}_{A}}$g/cm3,
故答案为:6;$\frac{288}{{a}^{3}{N}_{A}}$g/cm3.
点评 本题主要考查了分子结构、第一电离能、配合物的结构、简单分子或离子的空间构型、晶胞的计算,难度不大,注重基础知识的考查.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 无水硫酸铜、蔗糖 | B. | 硅胶、硫酸亚铁 | C. | 食盐、蔗糖 | D. | 生石灰、食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | FeCl3 | HI | H3PO4 | Ca(OH)2 |
| 弱电解质 | CH3COOH | HF | BaSO4 | HBr |
| 非电解质 | Cu | NH3 | H2O | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中.
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中.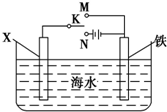 ,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于N处.若 X 为锌,开关K 置于N或M处.
,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于N处.若 X 为锌,开关K 置于N或M处.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:K+、Cu2+、NO3-、AlO2- | |
| B. | 空气:CH4、CO2、SO2、NO | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br - | |
| D. | 各离子物质的量浓度相等的溶液:K+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,一氧化氮能与空气中的氧气直接化合 | |
| B. | SiO2与酸、碱均不反应 | |
| C. | Na2O、Na2O2组成元素相同,两化合物都为碱性氧化物 | |
| D. | NO2通入FeSO4溶液中始终无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaBr的电子式: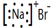 | B. | Na218O 中阴离子的结构示意图: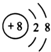 | ||
| C. | CH4的结构式: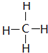 | D. | HF的电离方程式:HF?F-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池外电路中电子由负极流向正极 | |
| B. | 原电池中发生还原反应的电极是正极 | |
| C. | 电解池中发生还原反应的电极是阳极 | |
| D. | 电解池中质量增加的电极是阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com