
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确的是
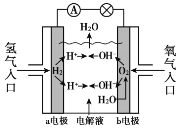
A. H2在负极发生氧化反应
B. 电子从a电极经外电路流向b电极
C. 供电时的总反应为:2H2 + O2 == 2H2O
D. 燃料电池的能量转化率可达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期主族元素,X、Y、Z原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。W的最外层电子数等于X的核外电子总数,且W单质常温下为固体。请回答下列问题:
(1)Z在周期表中的位置为______________。
(2)Y元素形成的离子的结构示意图为____________。
(3)X、Y、Z三种元素对应的原子半径大小关系为____________(填元素符号)。
(4)X和Z形成的简单氢化物,热稳定性较好的是______________(填化学式)。
(5)Y与X的最高价氧化物在一定条件下反应的实验现象是___________________________。
(6)下列说法正确的是_______。
A.W的氧化物,均满足8e—稳定结构
B.最高价氧化物对应的水化物的酸性W>Z
C.由于Z的氧化物ZO2既可与酸反应,又能与碱反应,所以ZO2为两性氧化物
D.W的氧化物WO2,具有还原性,能使酸性KMnO4溶液褪色
(7)足量的单质Y与一定量的W的最高价氧化物对应的水化物的浓溶液,在一定条件下充分反应,所得气体的成分为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案中均使用了NaCl溶液,能达到实验目的的是( )
编号 | A | B | C | D |
实验 方案 |
置于光亮处 |
|
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
|
实验 目的 | 验证甲烷与氯气发生化学反应 | 进行喷泉实验 | 验证Fe电极被保护 | 验证乙炔的还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3可作食用碱。下列方程式中正确的是( )
A.Na2O2与CO2反应生成Na2CO3:Na2O2 +CO2=Na2CO3+O2
B.Na2CO3溶液呈碱性:CO32-+H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.NaHCO3可作发酵粉:2NaHCO3![]() Na2CO3+CO2↑ +H2O
Na2CO3+CO2↑ +H2O
D.Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
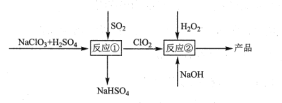
下列说法错误的是( )
A. 反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B. 若反应①通过原电池来实现,则ClO2是正极产物
C. 反应②中的H2O2可用NaClO2代替
D. 反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某校研究小组尝试回收废旧正极材料中的钴。
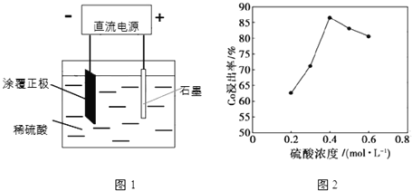
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O,阳极的电极反应式为______。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4molL-1时,钴的浸出率下降,其原因可能为______。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式______。该步骤一般在80℃以下进行,温度不能太高的原因是______。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是______(填字母序号)。
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
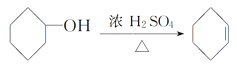 +H2O
+H2O
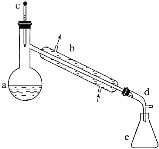
可能用到的有关数据如下:
相对分子质量 | 密度/ g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是______。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________。
(4)分液漏斗在使用前须清洗干净并______;在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A 圆底烧瓶 B 温度计 C 吸滤瓶 D 球形冷凝管 E 接收器
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com