
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某校研究小组尝试回收废旧正极材料中的钴。
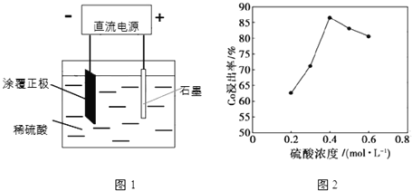
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O,阳极的电极反应式为______。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4molL-1时,钴的浸出率下降,其原因可能为______。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式______。该步骤一般在80℃以下进行,温度不能太高的原因是______。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是______(填字母序号)。
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]
【答案】4OH——4e—=O2↑+2H2O H+与LiCoO2在阴极的还原反应相互竞争,当c(H+)增大时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降 2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O 防止H2O2剧烈分解 ac
【解析】
(1)①阴离子在阳极放电,发生失电子的氧化反应,阳极氢氧根放电:4OH--4e-=O2↑+2H2O;
②电解过程中氢离子也可能在阴极放电,H+与LiCoO2在阴极的还原反应相互竞争,当c(H+)增大时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降;
(2)①“酸浸”过程中正极粉发生氧化还原反应,根据流程可知反应物有LiCoO2、H2O2、H2SO4,生成物中有Co2+,则该过程中Co元素被还原,则H2O2中氧元素被氧化,产物中应该有氧气,结合电子守恒和元素守恒可得方程式为2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;该步骤一般在80℃以下进行,反应物中有双氧水,双氧水不稳定,温度太高,双氧水会受热分解;
②(NH4)2C2O4溶液呈弱酸性,所以铵根的水解程度大于草酸根的水解程度,则
a.(NH4)2C2O4可以电离出两个铵根和一个草酸根,水解是微弱的,所以c(NH4+)>c(C2O42-)>c (H+)>c (OH-),故a正确;
b.由电荷守恒,可知c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故b错误;
c.由物料守恒,可知c(NH4+)+c(NH3H2O)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)],故c正确;
故答案为:ac。


科目:高中化学 来源: 题型:
【题目】能证明碳酸的酸性比硅酸强的事实是
A. 二氧化碳溶于水且能反应生成碳酸,二氧化硅不溶于水不能与水反应生成硅酸
B. 在高温下,二氧化硅与碳酸钠能发生反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
C. 二氧化硅的熔点比二氧化碳的熔点高
D. 二氧化碳通入硅酸钠溶液中,生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
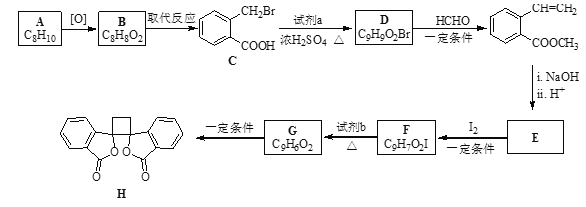
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
已知:i.RCH2Br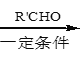 R-HC=CH-R’
R-HC=CH-R’
ii. R-HC=CH-R’ 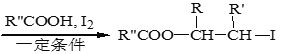
iii. R-HC=CH-R’ 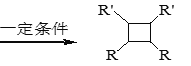
(以上R、R’、R’’代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是_________
(2)B的结构简式是__________。
(3)由C生成D的化学方程式是__________。
(4)由E与I2在一定条件下反应生成F的化学方程式是___________。
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成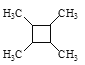 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ 有机物具有广泛的用途。现有下列有机物:①乙烯 ②1,3-丁二烯 ③甲醛 ④油脂。请将相应的序号填入空格内。
(1)能用于制备肥皂的是_________;
(2)能用于制备聚乙烯塑料的是_________;
(3)能用于制备顺丁橡胶的是____________;
(4)能用于制备酚醛树脂的是____________。
Ⅱ.按要求回答下列问题:
(1) 名称为____________。
名称为____________。
(2)A,B,C三种烃的化学式均为C6H10,它们的分子中均无支链或侧链。
①若A为环状,则其结构简式为________。
②若B为含有双键的链状结构,且分子中不存在“![]() ”基团,则其可能的结构简式为__________(任写一种)。
”基团,则其可能的结构简式为__________(任写一种)。
③若C为含有三键的链状结构,则其可能的结构简式及名称为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A~I的元素中选择符合题意的元素,按要求回答下列问题:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)只有负价而无正价的是______(填元素名称);
(2)最高价氧化物的水化物酸性最强的是____(填化学式);
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的化合物的结构式 _____;
(4)在B、C、D、J、 E、F、G、H中,原子半径最大的是____(填原子符号);
(5)画出上述元素中金属性最强的元素的原子结构示意图______;
(6)C单质与氢氧化钠溶液反应的离子方程式________________________;
(7)用电子式表示E单质的形成过程_______________________
(8)写出冶炼B单质的化学方程式____________________;
(9)D的最简单氢化物的燃烧热为890.3 kJ/mol,写出D的最简单氢化物燃烧热的热化学方程式_____;
(10)写出NaHSO4熔融时电离方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:
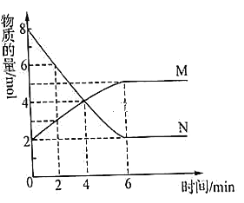
(1)反应的化学方程式为__。
(2)反应达到最大限度时,反应速率v(N)=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动潜艇的液氨![]() 液氧燃料电池原理示意如图,下列有关该电池说法正确的是
液氧燃料电池原理示意如图,下列有关该电池说法正确的是
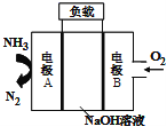
A.该电池工作时,每消耗22.4LNH3转移3mol电子
B.电子由电极A经外电路流向电极B
C.电池工作时,OH-向电极B移动
D.电极B上发生的电极反应为: ![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)硫酸铜晶体(CuSO4·5H2O)是铜盐中重要的无机化工原料,广泛应用于农业、电镀、饲料添加剂、催化剂、石油、选矿、油漆等行业。
Ⅰ.采用孔雀石[主要成分CuCO3·Cu(OH)2]、硫酸(70%)、氨水为原料制取硫酸铜晶体。其工艺流程如下:
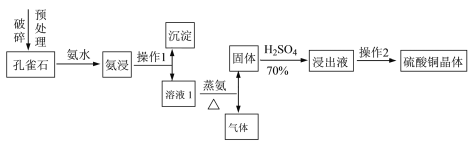
(1)预处理时要用破碎机将孔雀石破碎成粒子直径<1 mm,破碎的目的是____________________。
(2)已知氨浸时发生的反应为CuCO3·Cu(OH)2+8NH3·H2O![]() [Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色,请写出蒸氨时的反应方程式:______________________。
[Cu(NH3)4]2(OH)2CO3+8H2O,蒸氨时得到的固体呈黑色,请写出蒸氨时的反应方程式:______________________。
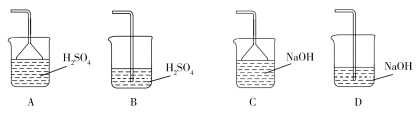
(3)蒸氨出来的气体有污染,需要净化处理,下图装置中合适的为___________(填标号);经吸收净化所得的溶液用途是_______________(任写一条)。
(4)操作2为一系列的操作,通过加热浓缩、冷却结晶、___________、洗涤、___________等操作得到硫酸铜晶体。
Ⅱ.采用金属铜单质制备硫酸铜晶体
(5)教材中用金属铜单质与浓硫酸反应制备硫酸铜,虽然生产工艺简洁,但在实际生产过程中不采用,其原因是______________________(任写两条)。
(6)某兴趣小组查阅资料得知:Cu+CuCl2![]() 2CuCl,4CuCl+O2+2H2O
2CuCl,4CuCl+O2+2H2O![]() 2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4
2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4![]() CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置如图:
CuSO4+CuCl2+2H2O。现设计如下实验来制备硫酸铜晶体,装置如图:
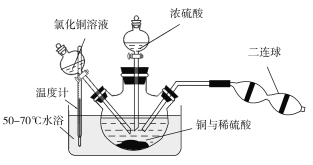
向铜和稀硫酸的混合物中加入氯化铜溶液,利用二连球鼓入空气,将铜溶解,当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸。
①盛装浓硫酸的仪器名称为___________。
②装置中加入CuCl2的作用是______________;最后可以利用重结晶的方法纯化硫酸铜晶体的原因为______________________。
③若开始时加入a g铜粉,含b g氯化铜溶质的氯化铜溶液,最后制得c g CuSO4·5H2O,假设整个过程中杂质不参与反应且不结晶,每步反应都进行得比较完全,则原铜粉的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com