
| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| C. | 加氢氧化钠溶液,加热,将干燥的红色石蕊试纸靠近试管口 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸靠近试管口 |
分析 A.氢氧化钠和氨水均是碱性,氢氧化钠会干扰氨气的检验;
B.氢氧化钠和氨水均能使石蕊试液显示蓝色;
C.红色石蕊试纸:此石蕊试纸用于鉴别碱性物质,使试纸变蓝色,一般干燥的试纸检验溶液,湿润的检验气体;
D.氨气具有碱性,能使湿润的红色石蕊试纸变蓝.
解答 解:检验铵盐的方法是:利用铵盐和氢氧化钠溶液在加热条件下生成氨气,用湿润红色石蕊试纸来检验,湿润红色石蕊试纸会变蓝色.
A.氢氧化钠和氨水均是碱性的,如果氢氧化钠相对于氨水过量则会干扰检验,滴入酚酞试剂变红不一定是氨水,故A错误;
B.氢氧化钠和氨水均是碱性的,均能使石蕊试液显示蓝色,如果氢氧化钠相对于氨水过量则会干扰检验,故B错误;
C.干燥的红色石蕊试纸遇氨气不变色,所以靠近试管口,无法检验氨气,故C错误;
D.将白色固体放入试管加热,用湿润的红色石蕊试纸放在试管口,湿润红色石蕊试纸会变蓝色,证明产生的气体是氨气,证明该盐中含有铵根离子,这是检验铵盐的方法,故D正确;
故选D.
点评 本题考查学生铵盐的检验方法,注意氨气是中学阶段唯一的一种碱性气体,可以据此来检验,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | c(A-)+c(HA)=0.02 mol•L-1 | B. | 该溶液的pH<7 | ||
| C. | HA的酸性很弱,A-水解程度较大 | D. | n(A-)+n(OH-)-n(H+)=0.01 mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的化学式为:K2O2 | B. | KNO3发生氧化反应 | ||
| C. | NaN3的电子式为 | D. | 氧化产物与还原产物质量比为1:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的活泼顺序为:a>c>b>d | |
| B. | 在①的溶液中,SO42-向b极移动 | |
| C. | 在③的装置中,一段时间后b电极质量将会减轻 | |
| D. | 二次电池放电时的反应和充电时的反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PO4的摩尔质量为98 | |
| B. | 阿伏伽德罗常数即为0.012kg12C所含的碳原子数 | |
| C. | 任何气体的摩尔体积均约为22.4L.mol-1 | |
| D. | 一个标准大气压下4℃时,9mL水中所含电子数约为3.01×1024. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
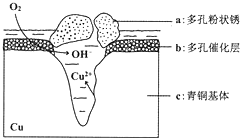 如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )| A. | 腐蚀过程中,铜被氧化 | |
| B. | 已知环境中的 Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,则其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 4.29 g Cu2(OH)3Cl,则理论上耗氧体积定为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
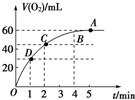 将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.
将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com