

| A. | ①所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | ②表明合成氨反应是放热反应,a表示在反应体系中加入了催化剂 | |
| C. | ③所示,t1℃时质量分数均为20%的甲、乙两种饱和溶液,升温到t2℃时,两种溶液中溶质的质量分数不再相等 | |
| D. | ④所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |
分析 A.由图可知,转化率不变,改变条件可能为加催化剂;
B.使用催化剂,降低反应所需的活化能;
C.t1℃时质量分数均为20%的甲、乙两种饱和溶液,由图可知,升高温度,甲的溶解度增大,乙的溶解度减小;
D.用水稀释pH相同的盐酸和醋酸,盐酸完全电离,其pH变化大;离子浓度大的导电性强.
解答 解:A.由图可知,转化率不变,改变条件可能为加催化剂,则a、b的压强可能相同,故A错误;
B.使用催化剂,降低反应所需的活化能,则b表示在反应体系中加入了催化剂,故B错误;
C.t1℃时质量分数均为20%的甲、乙两种饱和溶液,由图可知,升高温度,甲的溶解度增大,乙的溶解度减小,升高温度析出乙,则升温到t2℃时,两种溶液中溶质的质量分数不再相等,故C正确;
D.用水稀释pH相同的盐酸和醋酸,盐酸完全电离,其pH变化大,则Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:a>b>c,故D错误;
故选C.
点评 本题考查较综合,涉及平衡图象、反应活化能、质量分数与溶解度、pH及稀释计算等,注重高频考点的考查,把握图中纵横坐标的含义及点、线、面的含义是解答本题的关键,注意相关化学反应原理的应用,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3mL溶液装于试管,向试管中加入几滴KSCN溶液. | 若溶液变红色,则溶液含有Fe3+; 若无现象,则不含Fe3+ | Fe3++3SCN-=Fe(SCN)3 |
| 第二步 | 另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 | 若溶液紫色褪去,则溶液含有Fe2+; 若无明显变化,则不含Fe3+. | 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 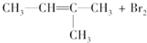 → → | |
| B. | CH2═CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | |
| C. | CH3-CH═CH2+H2O$→_{加热、加压}^{催化剂}$ | |
| D. | nCH2═CH2+nCH2═CH-CH3$→_{△}^{催化剂}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1g酒精和1g水混合后的总质量 | |
| B. | 100mL酒精与100mL水混合均匀后所得溶液的总体积 | |
| C. | 温度一定时1gH2O溶解1g硝酸钾后,所得溶液的质量 | |
| D. | 1g氢氧化钠溶液和1g醋酸溶液混合后溶液的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ①④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1 mol FeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 4.6 g Na与稀盐酸反应,转移电子数一定为0.2NA | |
| C. | 10.6 g Na2C03晶体中含CO${\;}_{3}^{2-}$数目为0.1NA | |
| D. | 常温下,22g CO2含碳氧双键数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com