
(11分)Ⅰ:在H2O2作用下可实现Fe(CN)63-与Fe(CN)64-之间的相互转化,在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-;在碱性溶液里H2O2可使Fe(CN)63-转化为Fe(CN)64-。写出以上相互转化的离子方程式。
① 酸性溶液中: ,
②碱性溶液中: 。
Ⅱ:膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。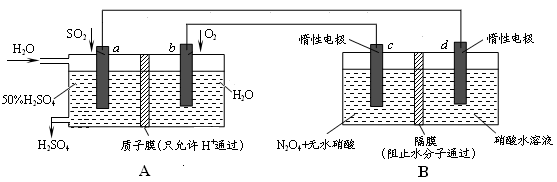
(3)A装置是________,B装置是_________(填“原电池”或“电解池”)。
(4)N2O5在装置中的______区(填“正、负极”或“阴、阳极”)生成,其电极反应式为______________。
(5)通入O2一极的电极反应式为_______________________________。
(1)2Fe(CN)64-+H2O2+2H+====2Fe(CN)63-+2H2O
(2) 2Fe(CN)63-+H2O2+2OH-====2Fe(CN)64-+2H2O+O2↑
(3)原电池 电解池
(4)阳极 N2O4+2HNO3-2e- 2N2O5+2H+
2N2O5+2H+
(5)O2+4H++4e- 2H2O
2H2O
解析试题分析:1、过氧化氢具有氧化性在酸性条件下将Fe(CN)64-氧化成Fe (CN)63-
在碱性条件下,过氧化氢将氢氧根离子氧化成氧气和水,Fe(CN)63-被还原为Fe(CN)64
3、根据两个装置图可以看到B中两个都是惰性电极,可知其是电解池。A为原电池。
4、氧气通入的一级为正极,可以推出N2O4和无水硝酸在阳极 发生的电极方程式为 N2O4+2HNO3-2e- 2N2O5+2H+
2N2O5+2H+
5、氧气在正极,得到电子被还原为水,O2+4H++4e- 2H2O
2H2O
考点:氧化还原反应,电解池和原电池,电极方程式的书写
点评:本题属于中等题,正确判断出N2O4和无水硝酸在阳极反应时解题的关键。


科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml) | 5 | 11 | 7 | 8 | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖南省高三第五次月考化学试卷(解析版) 题型:填空题
(11分)Ⅰ:在H2O2作用下可实现Fe(CN)63-与Fe(CN)64-之间的相互转化,在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-;在碱性溶液里H2O2可使Fe(CN)63-转化为Fe(CN)64-。写出以上相互转化的离子方程式。
① 酸性溶液中: ,
②碱性溶液中: 。
Ⅱ:膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。

(3)A装置是________,B装置是_________(填“原电池”或“电解池”)。
(4)N2O5在装置中的______区(填“正、负极”或“阴、阳极”)生成,其电极反应式为______________。
(5)通入O2一极的电极反应式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)H2O2的水溶液是一种常用的杀菌剂,其质量百分比一般为3%和30%。
1-1 在H2O2作用下可实现Fe(CN)63-与Fe(CN)64-之间的相互转化,在酸性溶液中H2O2可使Fe(CN)64-转化为Fe(CN)63-;在碱性溶液里H2O2可使Fe(CN)63-转化为Fe(CN)64-。写出以上相互转化的离子方程式 。
1-2 分别写出实验室、老工业、新工业制备H2O2的三种方法。
1-3 写出二种定量测定H2O2水溶液中H2O2含量的化学方程式和简要实验步骤。
1-4 将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失。甲学生认为这是由于H2O2是二元弱酸,消耗了OH-,而使红色褪去;乙学生认为,H2O2具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位学生的解释中哪种正确?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com