
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①②B.①④C.②③D.③④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如图所示的变化。
气体A![]()
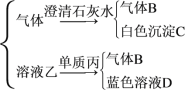
(1)写出下列物质的化学式:丙__,B___,C___,D___。
(2)写出甲跟乙反应的化学方程式:__。
(3)单质丙与溶液乙反应生成气体B的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是
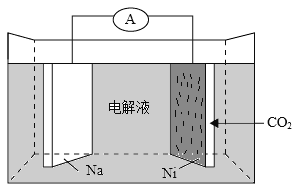
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一份澄清溶液, 可能含有 Na+、 K+、 NH4+、 Ca2+、 Fe3+、 SO42-、 CO32-、 SO32-、 Cl-、I-中的若干种, 且离子的物质的量浓度均为 0.1 mol·L-1(不考虑水解和水的电离)。 往该溶液中加入过量的盐酸酸化的 BaCl2 溶液, 无沉淀生成。 另取少量原溶液, 设计并完成如下实验:
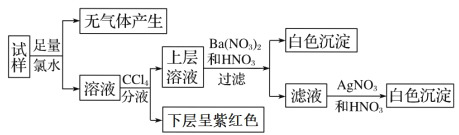
则关于原溶液的判断中不正确的是
A. 是否存在 Na+、K+需要通过焰色反应来确定
B. 通过CCl4 层的颜色变化,也能判断出原溶液中是否存在Fe3+
C. 虽然实验过程引入了氯元素, 但不影响原溶液是否存在Cl-的判断
D. 肯定不存在的离子是 Ca2+、Fe3+、SO42-、CO32-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
序列 | 参加反应的物质 | 生成物 | |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4…… | |
② | Cl2、FeBr2 | 只有FeCl3、FeBr3 | |
③ | KClO3、HCl(浓) | Cl2…… |
根据上表中信息判断,下列选项正确的是( )
A.氧化性由强到弱顺序为KClO3>Cl2>Fe3+>Br2
B.第②组反应中Cl2与FeBr2的物质的量之比为1:1
C.第③组反应中生成1molCl2,转移电子2mol
D.第①组反应的其余产物为H2O和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
A.砷原子的结构示意图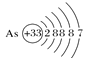 B.BF4—的结构式
B.BF4—的结构式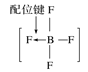
C.HF分子间的氢键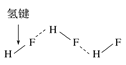 D.丙氨酸的手性异构
D.丙氨酸的手性异构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2 + 3H22NH3已达到平衡状态的是( )
①一个N≡N断裂的同时,有3个H-H键断裂
②一个N≡N键断裂的同时,有6个N-H键断裂
③其它条件不变时,混合气体平均式量不再改变
④保持其它条件不变时,体系压强不再改变
⑤NH3%、N2%、H2%都不再改变
⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.全部B.只有③④⑤C.②③④⑤⑦D.只有③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3 mol A气体和1 mol B气体通入一容积固定为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1 min时测得剩余1.8 mol A,C的浓度为0.4 mol/L,则1 min内,B的平均反应速率为___________;x为____________。
(2)若反应经2 min达到平衡,平衡时C的浓度______________0.8 mol/L(填“大于”、“小于”或“等于”)
(3)能加快反应速率的措施是____________。
①升高温度
②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar
④使用催化剂
⑤将容器体积缩小一半
(4)能够说明该反应达到平衡的标志是____________。
A.容器内混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.A、B的浓度之比为3:1
D.单位时间内断开3n mol A-A键的同时生成n mol B-B
E.v(A)=3v(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应的各物质浓度数据如下:
aA(g)+bB(g)![]() 2C(g)
2C(g)
起始浓度(mol·L-1) 3.0 1.0 0
2 s末浓度(mol·L-1) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是( )
A. 9∶3∶4B. 3∶1∶2C. 2∶1∶3D. 3∶2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com