
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 含有4molHCl的浓盐酸与足量MnO2反应,生成1molCl2
B. 78g Na2O2与足量水充分反应时电子转移数为2NA
C. 标准状况下,22.4L SO3中所含的SO3分子数为NA
D. 常温常压下,8g O2所含的质子数为4NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容基中,能表示反应X(气)+2Y(气)![]() 2Z(气)一定达到化学平衡状态的是( )
2Z(气)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2②X、Y、Z的浓度不再发生变化③容器中的压强不再发生变化④单位时间内生成nmolZ,同时消耗nmolY
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用.请回答下列问题:

(1)该“84 消毒液”的物质的量浓度约为__mol/L.( 保留小数点后 1 位)
(2)该同学参阅此“84 消毒液”的配方,欲用NaClO固体配制480mL 与市售物质的量浓度相同的“84 消毒液”,下列说法中正确的是__( 填序号).
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(3)“84 消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用 98%( 密度为1.84g/cm3)的浓硫酸配制 500mL 2.3mol/L 的稀硫酸用于增强“84 消毒液”的消毒能力.
①需用浓硫酸的体积为__mL.
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是__。
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液的质量 D.溶液的密度
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于2.3mol/L有__。
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为阳离子交换膜法电解精制的饱和食盐水原理示意图。其中阳离子交换膜仅允许Na+通过。下列说法错误的是
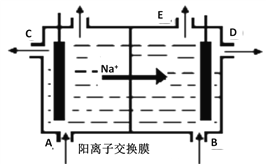
A. 从A口加入精制的浓食盐水
B. 从E口放出的气体是H2
C. D口导出的是含少量氯化钠的NaOH溶液
D. B口NaOH的浓度小于D口
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中数据是常温下HClO和H2CO3的电离常数,回答有关问题。

(1)下列能正确表示水解的离子方程式的是______________。
A.HCO3- + H2O![]() H2CO3+OH- B.HClO + H2O
H2CO3+OH- B.HClO + H2O![]() ClO-+ H3O+
ClO-+ H3O+
C.HCO3- + H2O![]() CO32--+H3O+ D.CO32-+2H2O
CO32--+H3O+ D.CO32-+2H2O ![]() H2CO3+2OH-
H2CO3+2OH-
(2)浓度相同的①Na2CO3;②NaHCO3;③NaClO三种溶液的pH由小到大排列的顺序为(用编号填写)________________________。
(3)写出NaClO溶液中通入少量CO2气体的离子方程式________________________。
(4)在新制氯水中加入少量碳酸氢钠粉末后,氯水的漂白能力增强,请用有关化学知识解释原因_____________________________________________。
(5)在等浓度的NaClO、NaHCO3混合溶液中,阴离子浓度的大小关系是__________。
(6)在pH=8的NaClO和HClO混合液中,c(ClO-)/c(HClO)=____________________。
(7)已知HClO(aq)与NaOH(aq)反应的ΔH =-a kJ/mol;HCl(aq)溶液与NaOH(aq)反应的ΔH =-b kJ/mol。则HClO在水溶液中电离的ΔH等于____________。
(8)pH=12的NaClO溶液中,c(HClO)=___________mol/L。(精确表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是 ( )
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下图所示实验,下列实验现象预测或操作正确的是

A. 实验甲:逐滴滴加盐酸时,试管中立即产生大量气泡
B. 实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色
C. 实验丙:从饱和食盐水中提取NaCl晶体
D. 装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(反应条件及部分产物已略去)。A、C、D中均含有相同的非金属元素,C、G为气体,D为淡黄色单质,I为常见强酸,反应③为化合反应。J溶液与KSCN溶液混合呈血红色。A中仅含两种元素,且元素质量比为7:8。

请回答下列问题:
(1)A的化学式为__________。
(2)H的电子式为__________。
(3)写出①的离子方程式为__________。
(4)写出②的化学方程式为____________并用单线桥标出电子转移方向和数目。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i. CH3OH(g) ![]() CO(g)+ 2H2(g) △H =+90kJ·mol-1
CO(g)+ 2H2(g) △H =+90kJ·mol-1
ii. CO(g)+H2O(g)![]() CO2(g)+ H2(g) △H =-41kJ·mol-1
CO2(g)+ H2(g) △H =-41kJ·mol-1
(1)向VL 恒容密闭容器中充入lmol CH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T) 变化关系的曲线为_______________(填“A”或“B”)。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L 恒容密闭容器中充入lmol CH3OH(g)和1molH2O(g),发生反应i和反应ii,体系中CO的平衡体积分数与温度(T)和压强(P)的关系如图2所示。
①P1、P2、P3由大到小的顺序为___________________。
②测得C点时、体系中CO2的物质的量为0.2mol,则T2℃时,反应ii 的平衡常数K=________。
Ⅱ.现有HA、HB 和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
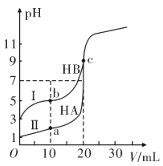
(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为_____________________________;
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
① 若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C 的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com