


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
| A、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ?mol-,则氢气的标准燃烧热为-241.8 kJ?mol-11 |
| B、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| C、已知2C(s)+2O2(g)=2CO2(g)△H=a2C(s)+O2(g)=2CO(g)△H=b,则a>b |
| D、已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
查看答案和解析>>
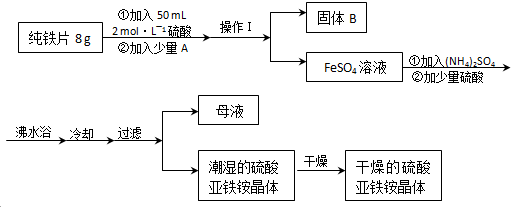
科目:高中化学 来源: 题型:
查看答案和解析>>
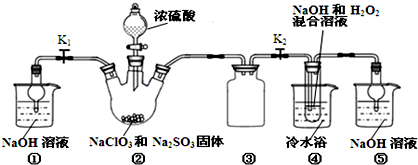
科目:高中化学 来源: 题型:
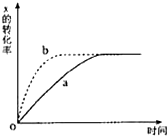 如图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进
如图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进| A、升高温度 |
| B、加大N的投入量 |
| C、缩小体积 |
| D、加大X的投入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
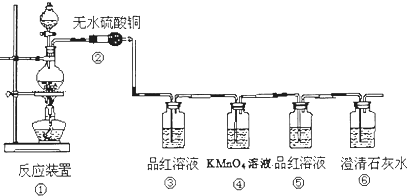
查看答案和解析>>
科目:高中化学 来源: 题型:
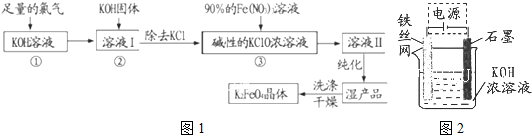
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液中加入过量氢氧化钠Ca2-+2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe2++3H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O═AlO2-+2NH4++2H2O |
| D、Na2S溶液呈碱性:S2-+H2O=HS-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥⑦ | B、②③⑤ |
| C、①③④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
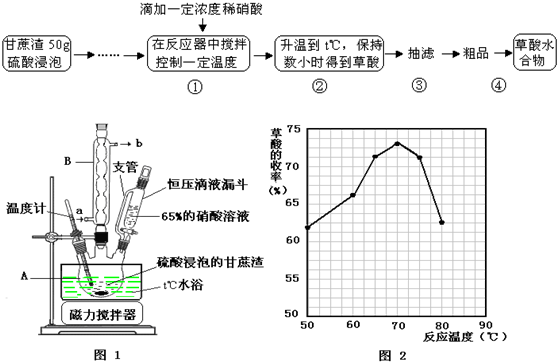
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com