
 或
或 .
.分析 (1)0.2molCxHy→1.2molCO2+1.2molH2O,由原子守恒确定A的分子式;根据反应方程式计算出生成氧气的物质的量和质量;
(2)B、C各3mol,即3molCO2、3molH2O,根据碳原子守恒计算出消耗烃A的物质的量;
(3)A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则只有一种H,为环己烷;
(4)比A少两个碳原子的A的烯烃同系物分子式为C4H8,根据同分异构体的书写原则写出丁烯的所有同分异构体即可.
解答 解:(1)0.2molCxHy→1.2molCO2+1.2molH2O,由原子守恒可知x=6,y=12,则烃A的分子式为C6H12;根据反应2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知生成氧气的总物质的量为:1.2mol×$\frac{1}{2}$+1.2mol×$\frac{1}{2}$=1.2mol,生成氧气的质量为:32g/mol×1.2mol=38.4g,
故答案为:C6H12;38.4;
(2)生成B、C各3mol,即3molCO2、3molH2O,根据C原子守恒可知消耗C6H12的物质的量为:3mol×$\frac{1}{6}$=0.5mol,
故答案为:0.5;
(3)若烃A不能因反应而使溴的四氯化碳溶液褪色,但在一定条件下能与氯气发生取代反应,其一氯代物只有一种,则只有一种H,为环己烷,其结构简式为: 或
或 ,
,
故答案为: 或
或 ;
;
(4)比A少两个碳原子的A的烯烃同系物分子式为C4H8,丁烯的同分异构体有:CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2,总有3种丁烯的同分异构体,
故答案为:3.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握质量守恒在确定有机物分子式中的应用方法.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题
 取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入盐酸,产生气体与所加盐酸体积之间的关系如图所示.
取x g NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成完全相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓缓加入盐酸,产生气体与所加盐酸体积之间的关系如图所示.| 化学式 | H2O | O2 | - |
| 物质的量(mol) | 0.05 | 0.00175 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
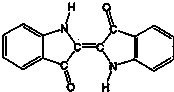
| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质是天然高分子化合物 | D. | 靛蓝中含苯环,属于芳香化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某烷烃主链上有4个碳原子的同分异构体有2种,含有相同碳原子数且主链上也是4个碳原子的单烯烃的同分异构体有( )
某烷烃主链上有4个碳原子的同分异构体有2种,含有相同碳原子数且主链上也是4个碳原子的单烯烃的同分异构体有( )| A. | 4种 | B. | 3种 | C. | 5种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
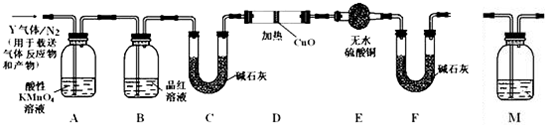
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2Cu+O2$\frac{\underline{\;△\;}}{\;}$2CuO可推出同族的硫也有Cu+S$\frac{\underline{\;△\;}}{\;}$CuS | |
| B. | Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 | |
| C. | Na能与水反应生成H2,K、Ca也能与水反应生成H2 | |
| D. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是表示物质数量的单位 | |
| B. | 1mol氢的质量是2g | |
| C. | O2的摩尔质量是32g | |
| D. | 每摩尔物质都含有阿伏伽德罗常数个指定微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 达菲的分子式为C16H30N2PO8 | |
| B. | 达菲、莽草酸、对羟基苯甲酸都属于芳香族化合物 | |
| C. | 利用FeCl3溶液可区别莽草酸和对羟基苯甲酸 | |
| D. | 1mol莽草酸与NaOH溶液反应,最多消耗4mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com