
����Ŀ����Ҫ������������⣺
(1)������пˮ��Һ�еμ��ʵ�Ũ�ȵİ�ˮ������������������Ҫ��Ӧ������ʵ������д��������Ҫ��Ӧ�����ӷ���ʽ__________��
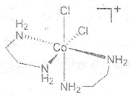
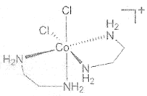
(2)1976����������ʵ��֤ʵ��trans-[Co(en)2Cl2]2Cl��HCl��2H2O������ֻ����3�����ӣ�X+�����ܵ�A+��Cl-��X+������ԭ�ӹ��棬�жԳ����ĺ�3�����ֱ�ľ��档(en���Ҷ�������д����)�� ����A+���������칹��Ľṹ��ͼ__________��
���𰸡���ɫ��Һ������ɫ�����������ܽ⡣Zn2++2NH3+2H2O=Zn(OH)2��+2NH4+��Zn(OH)2 +4NH3= [Zn(NH3)4]2++2OH- 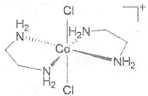
��������
��1����������п��Һ�м��백ˮʱ����ˮ�ļ��Կ���ʹZn2+����������������İ�ˮ�ǣ�Zn��NH3������Ϸ�Ӧ���ɿ�����ˮ���������[Zn(NH3)4]2+����Ӧ����Ϊ��ɫ��Һ������ɫ�����������ܽ⣬��Ӧ�ķ���ʽΪZn2++2NH3+2H2O=Zn(OH)2��+2NH4+��Zn(OH)2 +4NH3= [Zn(NH3)4]2++2OH-��
��2������Co��A+������[Co(en)2Cl2]-������ܵ������칹��ͼΪ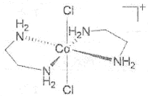 ��
��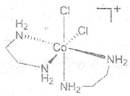 ��
�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X ��Y ��Z �����ڱ��е����λ�������ʾ��������Ԫ��ԭ�ӵ�����������֮��Ϊ21���ش��������⣺
W | X | |||
Y | Z |
(1) X��Ԫ�����ڱ��е�λ��Ϊ_______������X�ļ����ӽṹʾ��ͼ_______��
��֪XԪ�ص�һ��ԭ�ӣ���������Ϊ10��д������ԭ�ӵ�ԭ�ӷ���_____________��
(2)����Ԫ�ؼ����ӵİ뾶�ɴ�СΪ_____________(�����ӷ��ű���)��
(3)W��X������⻯���ȶ���Ϊ_______��________(�ѧʽ)��
(4)Z����������ˮ������Y����������Ӧˮ���ﷴӦ�Ļ�ѧ����ʽΪ______ ��
(5)ZX2������һ�ֹ���ɱ������������ҵ�Ͽ�����NaZX3��NaZ �������������Ƶ�ZX2 ͬʱ�õ�ZԪ�صĵ��ʣ��÷�Ӧ�����ӷ���ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ���ǣ� ��
A.��AgCl��AgBr�ı�����Һ�м�������AgNO3����Һ��![]() ����
����
B.��CH3COONa��Һ��20��������30�棬��Һ��![]() ����
����
C.�������м��백ˮ�����ԣ���Һ��![]() ��1
��1
D.��0.1molL-1CH3COOH ��Һ�м�������ˮ����Һ��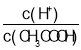 ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H��(aq)��OH��(aq)=H2O(l) ��H����57.3kJ/mol���ش��й��кͷ�Ӧ�����⡣
��1����0.1molBa(OH)2���ϡ��Һ������ϡ���ᷴӦ���ܷų�___kJ������
��2����ͼװ��������A������___��������___������B������___��������___������ĭ���ϵ�������___��
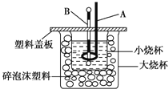
��3����ͨ��ʵ��ⶨ�к��ȵ���H�������������ڣ�57.3kJ/mol����ԭ�������___��
��4������ͬŨ�Ⱥ�����İ�ˮ(NH3��H2O)����NaOH��Һ��������ʵ�飬����к��ȵ���ֵ��___(�ƫ����ƫС������Ӱ�족)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�һ�������½������·�Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)����H����373.2kJ��mol-1���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ��(����)
N2(g)+2CO2(g)����H����373.2kJ��mol-1���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ��(����)
A.�Ӵ���ͬʱ�����¶�B.�Ӵ���ͬʱ����ѹǿ
C.�����¶�ͬʱ����N2D.�����¶�ͬʱ����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ��Cu2O����һ����;�㷺�Ĺ����ϣ�ij��������ͭ��ʯ����CuFeS2��Cu2S�ȣ�Ϊԭ����ȡCu2O�Ĺ����������£�
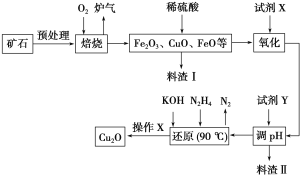
�����¼������ʿ�ʼ�γɳ�������ȫ����ʱ��pH���±���
Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ���� | 7.5 | 2.7 | 4.8 |
��ȫ���� | 9.0 | 3.7 | 6.4 |
(1)¯���е��к�����ɷ���__________��Cu2S��O2��Ӧʱ���������뻹ԭ�������ʵ���֮��Ϊ__________��
(2)���Լ�X��H2O2��Һ��д����Ӧ��Ӧ�����ӷ���ʽ��________�����Լ�X��______ʱ���������ڽ��������ɱ���
(3)�����Լ�Y��pHʱ��pH�ĵ��ط�Χ��___________��
(4)д����N2H4�Ʊ�Cu2O�Ļ�ѧ����ʽ��________������X����_________��ϴ�ӡ���ɣ����к��ʱҪ������������Ŀ����____________��
(5)��ͭ��ʯī���缫�����Ũ��ǿ������Һ���Ƶ�����Cu2O��д������������Cu2O�ĵ缫��Ӧʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л�ԭ�ԣ��ܹ�������ͭ����������ͼ�е�װ�ÿ���ʵ�ָ÷�Ӧ����֪�����������ȵ�����ͭ��Ӧ�õ������ͽ���ͭ���ش��������⣺
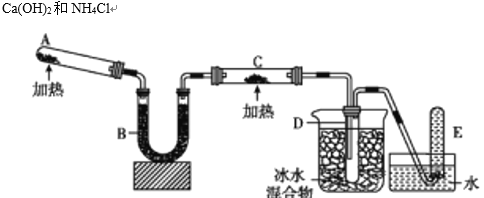
(1)д��A�з�Ӧ����ʽ��________________��
(2)д����������������ͭ�ķ�Ӧ����ʽ��________________��
(3)B�м���ĸ������________������ţ�
��Ũ���� ����ˮ�Ȼ��� �ۼ�ʯ��
(4)��֤����������ͭ��Ӧ��������C��________��
(5)D������ɫҺ�����ɡ�����D����ɫҺ��ijɷ�ʱ���õ�������һ��ҩƷ________������ţ�
A.![]() B.
B.![]() C.��ˮ����ͭ
C.��ˮ����ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ĵ���ƽ��������ͼ��ʾ������˵����ȷ����
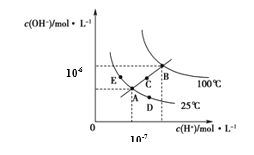
A.ͼ�����KW��Ĺ�ϵ��B>C>A=D=E
B.����A�㵽C�㣬�ɲ����¶Ȳ���ʱ��ˮ�м�������H2SO4 �ķ���
C.����A�㵽D�㣬�ɲ�����ˮ�м�������NaOH�ķ���
D.������B���¶�ʱ����pH=2��������pH=12��KOH�������Ϻ���Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������������
A.�к͵ζ�ʱʢ����Һ����ƿ��������ˮ�Եζ������Ӱ��
B.��NO2������ˮ����ɫ��dz��2NO2(g)(����ɫ)![]() N2O4(g)(��ɫ)��H��0
N2O4(g)(��ɫ)��H��0
C.������к͵ζ�ʵ���У�װ��Һ�ĵζ���������ϴ����ʵ����ƫ��
D.�����ȼ����Ϊ��H��-890.3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽΪ��CH4(g)��2O2(g)==CO2(g)��2H2O(g)��H��-890.3kJ��mol-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com