
【题目】铁在工业、农业和国防科技中有重要应用,我国已是生产钢铁最多的国家。回答下列问题:
(1) 工业上以磁铁矿和焦炭为原料冶炼铁存在以下变化:
①Fe3O4(s)+4C(s)=3Fe(s)+4CO(g) ΔH1=+678kJ·mol-1 ②CO(g)+![]() O2(g)=CO2(g) ΔH2=-283kJ·mol-1
O2(g)=CO2(g) ΔH2=-283kJ·mol-1
③C(s) +![]() O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
则ΔH4=____kJ·mol-1。
(2)铁矿石中常含有硫, 使高炉尾气中混有SO2, 除去高炉尾气中SO2 的物质是___。生产中发现, 无论怎么改变原料配比与条件, 在高炉尾气中始终有CO, 原因是___。
(3)在温度 aK时,反应Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)的浓度平衡常数Kc=16(用浓度计算所得),则用分压(分压等于总压×体积分数)代替浓度算得的平衡常数Kp ___Kc(填 “大于”“小于” 或 “等于”)。平衡混合气体中CO的体积分数为___(保留两位有效数字)。
(4) aK 时,在体积为 2L 的密闭容器中,加入 Fe、 Fe3O4、 CO、 CO2各1.0mol,气体的压强为PkPa。
①此时,v 正(CO2) ___v 逆(CO)(填 “大于”“小于” 或 “等于”), 反应经过5min后达到平衡, 该时间范围内的平均反应速率 v(CO2)=___mol/(L·min)(保留两位有效数字)。
②已知:恒容条件下,相同分子数的气体,其压强与温度成正比。平衡后温度从 aK逐渐升高到3aK, 请在下图中绘制出CO分压(PCO的变化曲线)_______ 。

【答案】-14 碱液(氢氧化钠溶液或氨水等) 高温下冶炼铁的反应是可逆反应,反应有限度(或反应要达到平衡),CO始终反应不完 等于 33% 大于 0.033或3.3×10-2 
【解析】
(1)工业上以磁铁矿和焦炭为原料冶炼铁存在以下变化:①Fe3O4(s)+4C(s)=3Fe(s)+4CO(g) ΔH1=+678kJ·mol-1 ②CO(g)+![]() O2(g)=CO2(g) ΔH2=-283kJ·mol-1③C(s) +
O2(g)=CO2(g) ΔH2=-283kJ·mol-1③C(s) +![]() O2(g)=CO(g) ΔH3=-110kJ·mol-1 ,根据盖斯定律:①+②×4-③×4得:④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4则ΔH4=+678kJ·mol-1 +(-283kJ·mol-1)×4-(-110kJ·mol-1)×4=-14kJ·mol-1。
O2(g)=CO(g) ΔH3=-110kJ·mol-1 ,根据盖斯定律:①+②×4-③×4得:④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4则ΔH4=+678kJ·mol-1 +(-283kJ·mol-1)×4-(-110kJ·mol-1)×4=-14kJ·mol-1。
故答案为:-14;
(2)SO2是酸性氧化物,除去高炉尾气中SO2 的物质是碱液(氢氧化钠溶液或氨水等)。生产中发现,无论怎么改变原料配比与条件,在高炉尾气中始终有CO,原因是高温下冶炼铁的反应是可逆反应,反应有限度(或反应要达到平衡),CO始终反应不完。故答案为:碱液(氢氧化钠溶液或氨水等);高温下冶炼铁的反应是可逆反应,反应有限度(或反应要达到平衡),CO始终反应不完;
(3)在温度 aK时,反应Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)的浓度平衡常数Kc=16(,因反应前后气体的体积不变,则用分压代替浓度算得的平衡常数Kp 等于Kc。
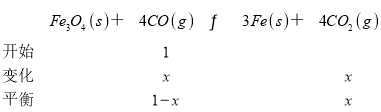
![]() =16,x=
=16,x=![]() ,平衡混合气体中CO的体积分数为
,平衡混合气体中CO的体积分数为 =30%(保留两位有效数字)。故答案为:等于;30%;
=30%(保留两位有效数字)。故答案为:等于;30%;
(4)aK 时,在体积为 2L 的密闭容器中,加入 Fe、 Fe3O4、 CO、 CO2各1.0mol,气体的压强为PkPa。
①此时,Qc=![]() =1<16=K,反应正向进行,v 正(CO2) 大于v 逆(CO), 反应经过5min后达到平衡,
=1<16=K,反应正向进行,v 正(CO2) 大于v 逆(CO), 反应经过5min后达到平衡,
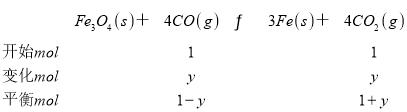
K=![]() =16,y=
=16,y=![]() mol,该时间范围内的平均反应速率 v(CO2)=
mol,该时间范围内的平均反应速率 v(CO2)=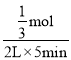 =0.033或3.3×10-2mol/(L·min)(保留两位有效数字)。故答案为:大于;0.033或3.3×10-2;
=0.033或3.3×10-2mol/(L·min)(保留两位有效数字)。故答案为:大于;0.033或3.3×10-2;
②恒容条件下,相同分子数的气体,其压强与温度成正比。平衡后温度从 aK逐渐升高到3aK,Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4=-14kJ·mol-1,反应是放热反应,升高温度平衡逆向移动,CO的物质的量增大,CO的物质的量在(![]() ,1)区间,压强在(
,1)区间,压强在(![]() p,3p)区间, CO分压(PCO的变化曲线)如图:
p,3p)区间, CO分压(PCO的变化曲线)如图: 。
。
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:

①尿素水溶液热分解为NH3和CO2,该反应的化学方程式:___。
②反应器中NH3还原NO2的化学方程式:___。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:__。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol-1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是__。
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示。

①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是__。
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__。
③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:___![]() □15NNO+□H2O___。
□15NNO+□H2O___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。
已知:P4(s,白磷)+5O2(g)=P4O10(s) ΔH=-2983.2 kJ·mol-1①
P(s,红磷)+![]() O2(g)=
O2(g)=![]() P4O10(s) ΔH=-738.5 kJ·mol-1②
P4O10(s) ΔH=-738.5 kJ·mol-1②
则白磷转化为红磷的热化学方程式为_______。相同状况下,能量状态较低的是______;白磷的稳定性比红磷的_______(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,选择其中8种元素。用这8种元素相关的化学用语回答下列问题:
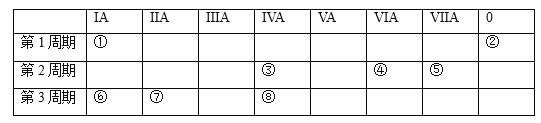
⑴化学性质最不活泼的是____________。
⑵元素最高价氧化物对应的水化物中,碱性最强的是__________;
⑶最活泼非金属单质的是_________;
⑷广泛应用于电子信息领域的是______;
⑸写出一种氢化物与氧化物之间反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】花青醛( )具有一种清新的花香,对香水和洗涤护理配方也非常有价值,下图是用Michael反应合成花青醛的一种合成路线。
)具有一种清新的花香,对香水和洗涤护理配方也非常有价值,下图是用Michael反应合成花青醛的一种合成路线。

已知:氨基连接在苯环上易被氧化。
回答下列问题:
(1)花青醛I中官能团的名称是___,可通过 直接判定___(选填编号)。
a.质谱 b.红外光谱 c.核磁共振氢谱
(2)A→B的反应方程式为___。
(3)B→C、C→D的反应类型分别是___、___。
(4)E的结构简式为____。
(5)对比分析说明,引入C→D与E→F步骤的目的是___。
(6)有机物G有多种同分异构体, 写出满足下列条件的一种同分异构体___。
①苯环上有3个取代基;②核磁共振氢谱有4个峰
(7)利用Michael反应, 以丙烯和 为原料合成
为原料合成 , 写出合成路线(无机试剂任选) ___。
, 写出合成路线(无机试剂任选) ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
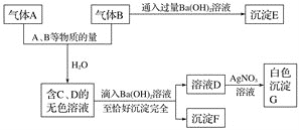
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示实验装置制取乙酸乙酯。回答以下问题:
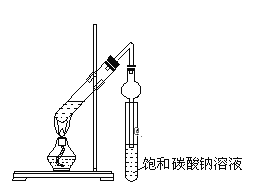
(1)在大试管中先加入3mL__,然后一边摇动一边慢慢地加入2mL___和2mL乙酸,混合均匀,然后加入几粒碎瓷片。按上图连好装置,用酒精灯对大试管小心均匀加热,当观察到明显现象时停止实验。
(2)加入浓硫酸的目的是:____,_____。
(3)加热前,大试管中加入几粒碎瓷片的作用是___。
(4)乙酸乙酯的密度比水____(填“大”或“小”),有___气味。
(5)与书中采用的实验装置的不同之处是:这位同学采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中,在此处球形干燥管的作用有:①____,②___。
(6)饱和碳酸钠溶液的作用是____、____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,列出8种元素在周期表中的位置。用化学用语回答下列问题:

⑴8种元素中,原子半径最小的是____,原子半径最大的是____,组成物质性质最稳定的是_____。
⑵由⑤组成的单质存在同素异形现象,所组成的同素异形体有:_________;
⑶⑥、⑦两种元素最高价氧化物对应的水化物中,碱性由强到弱的的是__________。
⑷元素⑧的氢化物的化学式为__________。该氢化物的主要用途:用作试剂、航空燃料。写出该氢化物在空气中燃烧的化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com