
【题目】写出下列物质的电子式:
⑴H2:______⑵O2:______⑶N2:______⑷NH3:______⑸NaOH:______
科目:高中化学 来源: 题型:
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
![]()
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
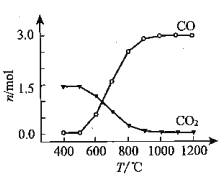
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:____________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
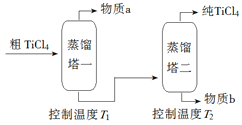
物质a是______________,T2应控制在_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员在钠离子电池研究中又取得新突破。钠离子电池与锂离子电池工作原理相同、制造工艺相似,而且具有资源丰富、成本低廉、安全性能好等特点。一种钠离子电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解质溶液为的碳酸丙烯酯溶液。
回答下列问题:
(1)基态Na原子的电子排布式为__,最高能层电子云轮廓图形状为___。
(2)Te与S同主族,与![]() 同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。
同周期,Te属于元素周期表中__区元素,其基态原子的价电子排布图(即轨道表示式)为___。
(3)碳酸丙烯酯的结构简式为![]() ,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。
,则其中π键和σ键的数目之比为___,碳原子的杂化轨道类型为____。
(4)C元素的最高价氧化物的电子式为___,CO32-的VSEPR模型名称是___,ClO4-的立体构型是__。
(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是__,该配离子包含的作用力为___(填选项字母)。
A.极性键 B.金属键 C.氢键 D.配位键
(6)由原料制备负极材料的反应过程中,是否有电子转移___(填“是”或者“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的密闭容器中通入0.4molSO2和0.2molO2发生反应2SO2+O2![]() 2SO3,下列叙述正确的是( )
2SO3,下列叙述正确的是( )
A. 若反应中加入的是18O2,达到平衡后SO2中不可能含有18O
B. 平衡时,SO3的浓度可能为0.2mol/L
C. 当不再生成SO3时反应达到平衡
D. 温度不变,改变SO2和O2的加入量,![]() 达到平衡时不变
达到平衡时不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2HI(g)![]() H2(g) +I2(g)的能量变化如图所示。下列说法正确的是
H2(g) +I2(g)的能量变化如图所示。下列说法正确的是

A. 常温下,向体积为VL的容器中充入2mol HI(g)充分反应,可吸收12.5kJ的热量
B. 加入催化剂,分子的能量不变,但单位体积活化分子数增多,速率加快
C. 其他条件不变,升高温度,反应速率加快,HI分解率不变
D. H2(g) +I2(g)![]() 2HI(g)的活化能Ea为12.5kJ·mol1
2HI(g)的活化能Ea为12.5kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在工业、农业和国防科技中有重要应用,我国已是生产钢铁最多的国家。回答下列问题:
(1) 工业上以磁铁矿和焦炭为原料冶炼铁存在以下变化:
①Fe3O4(s)+4C(s)=3Fe(s)+4CO(g) ΔH1=+678kJ·mol-1 ②CO(g)+![]() O2(g)=CO2(g) ΔH2=-283kJ·mol-1
O2(g)=CO2(g) ΔH2=-283kJ·mol-1
③C(s) +![]() O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
则ΔH4=____kJ·mol-1。
(2)铁矿石中常含有硫, 使高炉尾气中混有SO2, 除去高炉尾气中SO2 的物质是___。生产中发现, 无论怎么改变原料配比与条件, 在高炉尾气中始终有CO, 原因是___。
(3)在温度 aK时,反应Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)的浓度平衡常数Kc=16(用浓度计算所得),则用分压(分压等于总压×体积分数)代替浓度算得的平衡常数Kp ___Kc(填 “大于”“小于” 或 “等于”)。平衡混合气体中CO的体积分数为___(保留两位有效数字)。
(4) aK 时,在体积为 2L 的密闭容器中,加入 Fe、 Fe3O4、 CO、 CO2各1.0mol,气体的压强为PkPa。
①此时,v 正(CO2) ___v 逆(CO)(填 “大于”“小于” 或 “等于”), 反应经过5min后达到平衡, 该时间范围内的平均反应速率 v(CO2)=___mol/(L·min)(保留两位有效数字)。
②已知:恒容条件下,相同分子数的气体,其压强与温度成正比。平衡后温度从 aK逐渐升高到3aK, 请在下图中绘制出CO分压(PCO的变化曲线)_______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
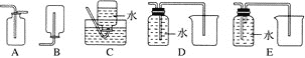
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氮气和水蒸气为原料,电化学合成氨装置(电极不参与反应)示意图如下。下列说法不正确的是

A.电极a连接电源的正极B.OH向电极a迁移
C.电极b的电极反应:N2+6e+6H+= 2NH3D.总反应:2N2+6H2O(g)![]() 4NH3+3O2
4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池为直流电源,进行电絮凝净水的实验探究,设计的实验装置如图所示。下列说法正确的是

A.Y电极反应为Pb+SO42--2e-=PbSO4
B.每消耗103.5gPb, 理论上电解池阴极上有1molH2生成
C.该电解池的总反应为2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D.若污水为含有Cr2O72-工业酸性废水,为将其转化为Cr3+除去,可让铁电极连接铅蓄电池的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com