
有关晶体的下列说法中不正确的是( )
|
| A. | 在NaCl晶体中,距Na+最近的Cl﹣形成正八面体 |
|
| B. | 在NaCl晶体中,每个晶胞平均占有4个Na+ |
|
| C. | 在CsCl晶体中,每个晶胞平均占有8个Cs+ |
|
| D. | 铜晶体为面心立方堆积,铜原子的配位数(距离一个铜原子最近的其它铜原子的个数)为12 |
考点:
离子晶体;金属晶体的基本堆积模型.
专题:
化学键与晶体结构.
分析:
A.氯化钠晶体中,钠离子的配位数是6,6个氯离子形成正八面体结构;
B.利用均摊法计算每个晶胞含有的钠离子个数;
C.利用均摊法计算每个晶胞中含有的铯离子个数;
D.铜晶体是面心立方堆积,采用沿X、Y、Z三轴切割的方法确定其配位数.
解答:
解:A.氯化钠晶体中,距Na+最近的Cl﹣是6个,即钠离子的配位数是6,6个氯离子形成正八面体结构,故A正确;
B.在NaCl晶体中,每个晶胞平均占有的Na+个数=1+12×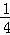 =4,故B正确;
=4,故B正确;
C.在CsCl晶体中,铯离子在晶胞的体心上,所以每个晶胞平均占有Cs+个数是1,故C错误;
D.铜晶体是面心立方堆积,采用沿X、Y、Z三轴切割的方法知,每个平面上铜原子的配位数是4,三个面共有4×3=12个铜原子,所以每个铜原子的配位数是12,故D正确;
故选C.
点评:
本题考查了晶体的结构,难度较大,具有丰富的空间想象能力是解本题的关键,易错选项是D,采用沿X、Y、Z三轴切割的方法即可确定其配位数.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g
H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是( )
a.体积②>③>①>④b.密度②>③>④>①
c.质量②>③>①>④d.氢原子个数①>③>④>②
A.abc B. bcd C. abcd D. acd
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的比较顺序中,不正确的是( )
|
| A. | 热稳定性:NH3>PH3>SiH4 |
|
| B. | 微粒半径:K+>Na+>Mg2+>Al3+ |
|
| C. | 氢键的作用能F﹣H…F>O﹣H…O>N﹣H…N |
|
| D. | 电负性:F>N>O>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于几种分子中的化学键描述不正确的是( )
|
| A. | 苯每个碳原子的未参加杂化的2p轨道形成大π键 |
|
| B. | CH4中的4个C﹣H键都是H的1s轨道与C的2p轨道形成的s﹣p σ键 |
|
| C. | C2H4中,每个碳原子的sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 |
|
| D. | H2分子中存在s﹣s σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B都是短周期元素,原子最外层电子排布式分别为(n+1)sx、nsx+1npx+3.A与B可形成化合物D.D溶于水时有气体逸出,该气体能使带火星的木条复燃.请回答下列问题:
(1)比较电离能:I1(A) I1(B)(填“>”或“<”,下同),比较电负性:A B.
(2)通常A元素的化合价是 ,对A元素呈现这种价态进行解释:
①用原子结构的观点进行解释: .
②用电离能的观点进行解释: .
③写出D跟水反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一配制一定浓度的醋酸溶液
(1)取冰醋酸配制250mL0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 和 .
实验二 探究浓度对醋酸电离程度的影响
测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol•L﹣1) | 0.0010 | 0.100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(2)表中数据是利用 (填仪器名称)测得的,根据表中数据,可以得出醋酸是 (填“强电解质”或“弱电解质”),你得出此结论的依据是
(3)已知10﹣2.73=1.86×10﹣3,利用此数据可以求得0.2000mol•L﹣1醋酸溶液的电离度α=
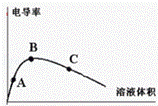
(4)用水稀释冰醋酸,电导率随加入水量的变化如右图所示A、B、C三点的电离度由大到小排列:
实验三 探究 对醋酸电离程度的影响
某同学利用传感器技术(如右下图),将20mL,0.1mol/L醋酸溶液放置在可加热磁力搅拌器上,并用pH传感器测量溶液的pH,利用电脑处理实验数据并作图(如下图)
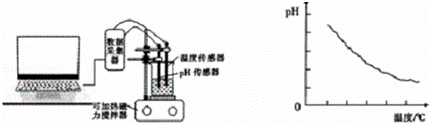
(5)由数据处理结果可以得到的结论是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为( )
|
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
|
| B. | NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
|
| C. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
|
| D. | 氨气分子是极性分子而甲烷是非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com