
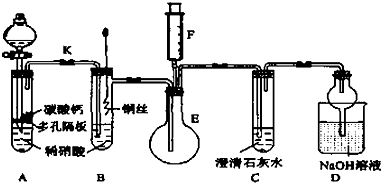


科目:高中化学 来源: 题型:
| A、a+11 | B、a-5 |
| C、a+3 | D、a+8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
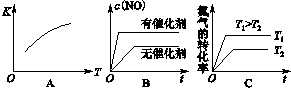
查看答案和解析>>
科目:高中化学 来源: 题型:
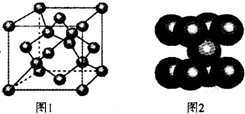 A、B、C、N、O、Si、Fe等元素及其化合物有重要的应用.
A、B、C、N、O、Si、Fe等元素及其化合物有重要的应用. b.CH4 c.CH2=CHCH3 d.CH3C≡CH
b.CH4 c.CH2=CHCH3 d.CH3C≡CH查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 在蔗糖中加入几滴水搅拌均匀,再加入浓硫酸,迅速搅拌 | 蔗糖逐渐变黑,体积膨胀,形成疏松多孔的物质 | 体现了浓硫酸的脱水性、氧化性及酸性 |
| B | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生红色沉淀 | 淀粉水解可生成葡萄糖 |
| C | 硫酸铵溶液滴入蛋白质溶液中 | 生成白色沉淀 | 蛋白质溶液发生了盐析 |
| D | 苯滴入溴水中并充分振荡,并静置 | 溴水不褪色 | 苯与溴水不发生化学反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2v(NH3)=v(CO2) |
| B、密闭容器中总压强不变 |
| C、密闭容器中混合气体的平均摩尔质量不变 |
| D、密闭容器中氨气的体积分数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com