
ͭ����������ʹ�õĽ���֮һ���й�ʹ��ͭ����ʷ�����Զ����Լ��������ǧ����ǰ�й��˵����Ⱦͷ��ֲ���ʼʹ��ͭ����ͭ�������Ľ��������Ϻ�ɫ����չ�Ժã������Ժ͵����Ըߣ�����ڵ��º͵���������Ԫ������õIJ��ϣ���ش��������⣺
(1)��CuSO4��ҺΪ�������Һ���д�ͭ(��Al��Zn��Ag��Pt��Au������)�ĵ�⾫��������˵����ȷ����_______(��ѡ����ĸ)

a.��ͭ�ӵ�Դ����,����������Ӧ
b.��Һ��Cu2+�������ƶ�
c.�������У������������������仯���
d.����������ɻ���Al��Zn�Ƚ���
(2)Ŀǰ�ĵ�·�壬��Ҫ����·��ͼ����ɣ���·����Ϊԭ��֮�䵼ͨ�Ĺ��ߣ�������ϻ�������ƴ�ͭ����Ϊ�ӵؼ���Դ�㣬��ӡˢ��·ʱ�����Ȼ�����Һ��Ϊ����ʴҺ���������ķ�ӦΪ______________��
(3) Cu�����ã�ͨ������²���ϡ���ᷴӦ������Cu��ϡ����Ļ�����е���H2O2��Һ����Һ�ܿ����ɫ����д���÷�Ӧ�����ӷ���ʽ___________________��
(4)Cu2O�е�Cu+���ȶ�����Cu2O�μ�ϡ���ᣬ���Ϻ�ɫ�������ɣ���Һ��Ϊ��ɫ��д����Ӧ�����ӷ���ʽ_________________��
(5)����ͭ��ԭ����Cu2+O2 2Cu+SO2���ڸķ�Ӧ��ÿ����1molCu��ת��________mole-��
2Cu+SO2���ڸķ�Ӧ��ÿ����1molCu��ת��________mole-��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�����и߶���ѧ����ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾ��ͬ�¶���ˮ��Һ��c(H��)��c(OH��)�Ĺ�ϵ�������ж���ȷ����( )
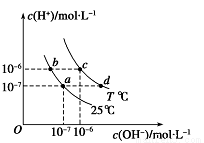
A. ֻ�������µķ�ʽ������a����d��
B. T<25
C. b���c��pH��Ϊ6����Һ������
D. ������������������c (H��) ��c (OH��)��Kw
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ��«���и�һ��ѧ��ѡ�ο��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��Ӧ��
��Cl2+2KBr=2KCl+Br2��
��KClO3+6HCl=3Cl2��+KCl+3H2O��
��2KBrO3+Cl2=Br2+2KClO3��
����˵����ȷ���ǣ�������
A. ����������Ӧ���е������ɣ����Զ����û���Ӧ
B. ��Ӧ����lmol��ԭ����Ӧ���������õ����ӵ����ʵ���Ϊ2mol
C. ��Ӧ���л�ԭ���������������ʵ���֮��Ϊ6��1
D. ��������ǿ����˳��Ϊ KBrO3��KClO3��Cl2��Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ������ѧ���ڳ����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A. ��ˮ�в���ͨ��CO2������CO2�����ӣ�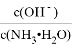 ���ϼ�С
���ϼ�С
B. ��ͭ�ľ��������У���ת��1mol���ӣ�������һ���ܽ�32gCu
C. �����£���Ӧ4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)�ġ�H>0����S<0
D. ����ͼ�еĻ�����������A���̶���������ɫ�ȱ���ٱ�dz��������ʼʱ��
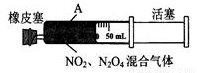
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ������ѧ���ڳ����Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
M��һ�ֻ���ԭ�ϣ������Ʊ�һϵ�����ʣ�����ͼ����
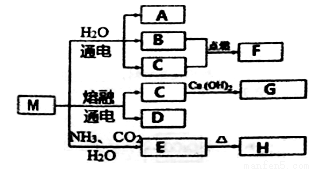
����˵����ȷ����
A. Ԫ��C��D�γɵļ����Ӱ뾶��ǰ�ߴ��ں���
B. F�����ȶ��Ա�H2S��
C. ������A��F�л�ѧ����������ͬ
D. Ԫ��C��D������������ˮ��������Ժ�H������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и߶���ѧ�ڿ�ѧ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���г��������KCl�ı�����Һ���ŵ�пͭԭ��ع���ʱ��������������ȷ����
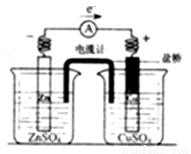
A. �û�ԭ�Խ�ǿ��������Ϊ���������������ṩ���ӣ��������Խ�ǿ��������Ϊ���������������·�õ�����
B. �����е�K+������ZnSO4��Һ��Cl-����CuSO4��Һ��ʹ�������ر�������
C. ���ŵ����룬�����Znֱ����CuSO4��Һ��Ӧ����ԭ��ع���Ч�ʵ�����
D. �ŵ�ʱ�������ϵĵ���ͨ������������������ͨ����Һ�������γɵ��ڵ�·���ɻ�·
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�߶���ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ������
��һ������������Ű�����ཡ������������Ӱ�죮ȼú������β������ɿ�����Ⱦ��ԭ��֮һ��
��1������β����������Ҫԭ��Ϊ��2NO��g��+2CO 2CO2��g��+N2��g����H��O
2CO2��g��+N2��g����H��O
�ٷ�Ӧ������-ʱ��ͼ����ͼ����ʾ���������������䣬���ڷ�Ӧǰ������ʵĴ�����������ʱ��ͼ����ͼ����ʾ������˵����ȷ����___________�����Ӧ��ĸ����

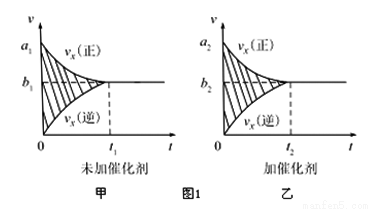
A��a1��a2 B��b1��b2 C��t1��t2
D��ͼ������Ӱ����������� E��ͼ������Ӱ�����������
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����_________������ţ�

��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⣮úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
��֪��CH4��g��+2NO2��g�� N2��g��+CO2��g��+2H2O��g����H=��867kJ/mol
N2��g��+CO2��g��+2H2O��g����H=��867kJ/mol
2NO2��g�� N2O4��g����H=��56.9kJ/mol H2O��g��=H2O��l����H=��44.0kJ/mol
N2O4��g����H=��56.9kJ/mol H2O��g��=H2O��l����H=��44.0kJ/mol
д��CH4����ԭN2O4��g������N2��H2O��l�����Ȼ�ѧ����ʽ��______________��
��3��CH4��H2O��g�� �ڴ������淢����ӦCH4+H2O?CO+3H2���÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�������
�¶�/�� | 800 | 1000 | 1200 | 1400 |
ƽ�ⳣ�� | 0.45 | 1.92 | 276.5 | 1771.5 |
�ٸ÷�Ӧ��_________��Ӧ������ȡ����ȡ�����
��T��ʱ����1L�ܱ�������Ͷ��l mol CH4��l mol H2O��g����ƽ��ʱc��CH4��=0.5mol/L�����¶��·�ӦCH4+H2O CO+3H2��ƽ�ⳣ��K=______________��
CO+3H2��ƽ�ⳣ��K=______________��
����������ʱ����2molA��2molB����Ͷ��̶��ݻ�Ϊ2L�ܱ������з�����Ӧ��2A(g)��B(g)  xC(g)��D(s)��10sʱ�����A�����ʵ���Ϊ1.7mol��C�ķ�Ӧ����Ϊ0.0225mol��L��1��s��1��40sʱ��Ӧǡ�ô���ƽ��״̬����ʱB��ת����Ϊ20%������д���пհף�
xC(g)��D(s)��10sʱ�����A�����ʵ���Ϊ1.7mol��C�ķ�Ӧ����Ϊ0.0225mol��L��1��s��1��40sʱ��Ӧǡ�ô���ƽ��״̬����ʱB��ת����Ϊ20%������д���пհף�
��1��x=____________
��2���ӷ�Ӧ��ʼ��10s��B��ƽ����Ӧ����Ϊ____________
��3���ӷ�Ӧ��ʼ��40s��ƽ��״̬��A��ƽ����Ӧ����Ϊ____________
��4��ƽ��ʱ������B���������Ϊ____________
��5�����и����ܱ�ʾ�÷�Ӧ�ﵽƽ��״̬��____________
A������A�����ʵ���������D�����ʵ���֮��Ϊ2��1
B��������A��B�����ʵ��� n(A)��n(B) =2��1
C�������ƽ����Է����������ٱ仯
D��ѹǿ���ٱ仯
E�������ܶȲ��ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ӱ�ʡ������ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��Ӧ2A(g) 2B(g)��C(g)(����ӦΪ���ȷ�Ӧ)���ﵽƽ��ʱ��Ҫʹ�淴Ӧ���ʽ��ͣ�A��Ũ������Ӧ��ȡ�Ĵ�ʩ�� (����)
2B(g)��C(g)(����ӦΪ���ȷ�Ӧ)���ﵽƽ��ʱ��Ҫʹ�淴Ӧ���ʽ��ͣ�A��Ũ������Ӧ��ȡ�Ĵ�ʩ�� (����)
A. ��ѹ B. ���� C. ��ѹ D. ����B��Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���½����ŵڶ�ʦ��ɽ��ѧ�߶���ѧ��ѧǰ���Ի�ѧ�Ծ��������棩 ���ͣ������
̼���γɻ�������������Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ���ʡ���ش��������⣺
��1���л���M����̫������տ�ת����N��ת���������£�
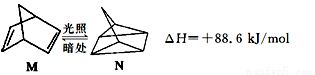
��M��N��ȣ����ȶ�����____________��
��2����֪CH3OH(l)��ȼ����Ϊ726.5kJ��mol��1��CH3OH(l) + 1/2O2(g) �T CO2(g) + 2H2O(g)
��H=��akJ��mol��1����a_____726.5�����������������=������
��3��ʹCl2��H2O(g)ͨ�����ȵ�̿�㣬����HCl��CO2������1molCl2���뷴Ӧʱ�ͷų�145kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ_______________________��
��4������͵�������ı������������ʡ���ʯī�����ۺͶ������Ѱ�һ����������ڸ��������գ��������ʿ������²��ϣ�4Al(s)+3TiO2(s)+3C(s)�T2Al2O3(s)+3TiC(s) ��H=��1176kJ��mol��1����Ӧ�����У�ÿת��1mol���ӷų�������Ϊ_________________��
��5����֪��Fe2O3(s)+3C(ʯī)=2Fe(s)+3CO(g) ��H=+489.0kJ��mol��1
CO(g)+1/2O2(g)=CO2(g) ��H=��283.0kJ��mol��1
C(ʯī)+O2(g) =CO2(g) ��H=��393.5kJ��mol��1
��4Fe(s)+3O2(g)=2Fe2O3(s) ��H=______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com