
【题目】下列根据实验操作所得出的现象和结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成红色 | 原溶液中含有Fe2+ |
B | 将变黑的银器放入装满食盐水的铝盆中,二者直接接触 | 银器恢复往日光泽 | 2Al+3Ag2S+6H2O=6Ag+2Al(OH)3+3H2S↑ |
C | 向铬酸钾溶液中加入硫酸[已知:Cr2O72- (橙色)+H2O | 溶液由橙色变为黄色 | Cr2O72-转变为CrO42- |
D | 将石蜡油气化后,使气体流经碎瓷片,将生成的气体通入酸性高锰酸钾溶液 | 溶液紫红色褪去 | 碎瓷片的主要作用是使石蜡油受热均匀 |
A.AB.BC.CD.D
【答案】B
【解析】
A.该溶液中滴加KSCN溶液后变成红色,说明滴加氯水后的溶液中含有Fe3+,Fe3+可能是原溶液中含有的,也可能是Fe2+被氯水氧化产生的,因此不能确定原溶液中是否含有Fe2+,A错误;
B.将铝片和银器插入一个盛食盐水的烧杯中处理,发生原电池反应,负极发生氧化反应,Al失去电子生成Al3+,电极反应式为:Al-3e-=Al3+,正极发生还原反应,Ag2S获得电子生成Ag与S2-,电极反应式为3Ag2S+6e-═6Ag+3S2-,Al3+与S2-发生双水解反应反应,生成Al(OH)3与H2S气体,故总的反应方程式为:2Al+3Ag2S+6H2O=2Al(OH)3↓+6Ag+3H2S↑,B正确;
C.铬酸盐溶液呈黄色,加入硫酸,溶液中c(H+)增大,化学平衡逆向移动,CrO42-转变为Cr2O72-,溶液显橙色,C错误;
D.石蜡油高温分解实验中,碎瓷片起到催化作用,D错误;
故合理选项是B。


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,也可由咖啡酸合成,下列说法不正确的是( )
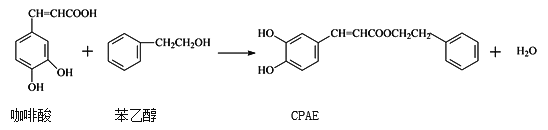
A. 1mol CPAE与足量的溴水反应,最多消耗4mol Br2
B. 咖啡酸可发生聚合反应,而且其分子中含有3种官能团
C. 与苯乙醇互为同分异构体的酚类物质共有9种
D. 可用金属Na检测上述反应是否残留苯乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
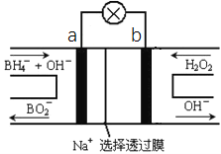
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
C. 电池放电时Na+从b极区移向a极区
D. 电极a采用MnO2,MnO2既作电极材料又有催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物M的合成路线如下:
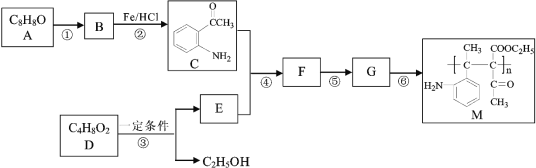
已知: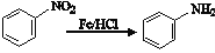
(1)A中含氧官能团的名称是______。
(2)反应①的试剂和条件为_______,B的结构简式为_________。
(3)写出反应的①化学方程式__________。
(4)写出反应的⑥化学方程式________。
(5)D为酯类,2D → E + C2H5OH,F中含有醇羟基,写出下列物质的结构简式: E______ 、F_______。
(6)反应①~⑥中属于取代反应的有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素D又称麻黄碱是一种天然的生物碱。天然麻黄素D的结构如图所示:
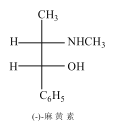
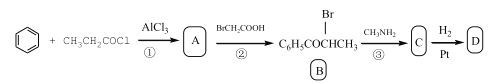
已知D的合成路线如下:
回答下列问题:
(1)写出反应①的化学方程式:______。指出其反应类型______。
(2)指出B中的官能团的名称______、D分子中有______个手性碳原子。
(3)出C→D的化学方程式:______。
(4)同时符合下列条件的C的同分异构体(不计立体异构)的数目共______种。
①属于对位二取代苯
②含有酰胺基(-CONH2)
(5)已知:R——NO2![]() R——NH2、氨基有碱性且易被氧化。设计一条由
R——NH2、氨基有碱性且易被氧化。设计一条由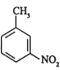 和乙醇为原料,制备
和乙醇为原料,制备 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。请回答下列问题:
(1)利用焰色反应可以定性鉴别某些金属盐。灼烧SrSO4时,锶的焰色为_____(填标号)。 A.洋红色 B.浅紫色 C.黄绿色 D.淡蓝色
(2)硫化锶(SrS)可用作发光涂料的原料,SrSO4和碳的混合粉末在隔绝空气下高温焙烧可生成硫化锶和一种还原性气体, 该反应的化学方程式____________________________。
(3)已知:25℃时,K sp(SrSO4)=3.2×10-7,K sp(SrCO3)=1.1×10-10。SrSO4的粉末与Na2CO3溶液混合加热、充分搅拌可生成硫酸钠和碳酸锶,若转化完成时恢复到25℃,混合液中c(CO![]() )=1.0×10-3mol/L,则c(SO
)=1.0×10-3mol/L,则c(SO![]() )=______________________。
)=______________________。
(4)以天青石生产Sr(OH)2·xH2O的工艺如下:

已知: Sr(OH)2 、Ca(OH)2在水中的溶解度如下表:
温度/(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①滤渣2为混有CaCO3的SrCO3,写出反应1生成SrCO3的化学方程式______________。
②固体3 “加热水浸”是为了获得较纯净的Sr(OH)2溶液/span>,此时应缓慢加热使沉淀颗粒长大,滤渣5的主要成分是______(填化学式),“趁热过滤”的目的是_________________________________。
③“操作6”主要有:________________、过滤、洗涤、干燥。
④取m g纯净Sr(OH)2·x H2O产品溶于水,加入过量Na2CO3溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=__________(用含m、n的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.将纯水加热的过程中,Kw变大、pH变小
B.配制FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1mol/L氨水中加入少量水,溶液中![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为制取NH3并探究其性质,按下图装置进行实验。(制取氨气的反应原理:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3+2H2O,部分夹持仪器已略去)
CaCl2+2NH3+2H2O,部分夹持仪器已略去)
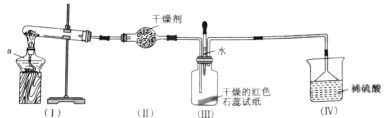
(实验探究)(1)装置(I)中仪器a的名称是_____。
(2)装置(Ⅱ)中可用_________(填“碱石灰”或“食盐”)作干燥剂。
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,观察到试纸颜色变为___(填“白色”或“蓝色”)原因是氨水呈____(填“碱性”或“酸性”)。
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,观察到瓶内充满_______(填“白烟”或“白雾”),写出NH3与HCl反应生成NH4Cl的化学方程式:_________。
(5)装置(IV)中稀硫酸的作用是___________。
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,理论上可生成NH3的物质的量是____mol。
(实验拓展)(7)已知:2NH3+3CuO![]() 3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____(填“白色”或“红色”),在这过程中NH3表现出__(填“还原性”或“氧化性”)。
3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____(填“白色”或“红色”),在这过程中NH3表现出__(填“还原性”或“氧化性”)。
(知识应用)(8)氨气是一种重要的化工原料。写出它的一种用途:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com