
| A. | 离子晶体中只有离子键 | |
| B. | 非金属元素只能形成共价键 | |
| C. | 水分子中存在氢键,所以水的沸点较高 | |
| D. | 原子晶体的熔点不一定比金属晶体的熔点高 |
分析 A.离子晶体中一定含有离子键,可能含有共价键;
B、非金属元素可能形成共价键,如氯化铵;
C、水分子间存在氢键,而不是分子中;
D、一般来说,原子晶体的熔点大于金属晶体.
解答 解:A、离子晶体中还可以含有共价键,如氢氧化钠和氯化铵,故A错误;
B、非金属元素也能形成离子键,如氯化铵等,故B错误;
C、水分子间存在氢键,所以水的沸点较高,故C错误;
D、一般来说,原子晶体的熔点大于金属晶体,而金属钨的熔点很高,则原子晶体的熔点不一定比金属晶体的高,故D正确;
故选D.
点评 本题考查化学键、晶体类型及性质等,为高频考点,把握物质类别与化学键的关系为解答的关键,注意构成微粒及晶体性质的分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
| A. | 将一滴碳酸钠溶液滴入一硼酸溶液中一定能观察到有气泡产生 | |
| B. | 将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生 | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积的0.1 mol•L-1NaOH溶液:c(H2CO3)+c(H+)+c(HCO3-)=c(OH-)+c(CO32-) | |
| D. | 等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
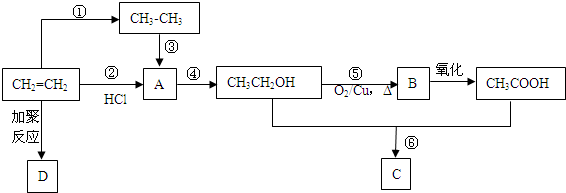
 .
. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③⑤⑥⑦ | C. | 只有①⑦ | D. | ③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 571.6 kJ•mol-1 | B. | 482.6 kJ•mol-1 | C. | 285.8 kJ•mol-1 | D. | 241.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和乙醇 | B. | 甲醇和乙醛 | C. | 丁烷和乙酸乙酯 | D. | 葡萄糖和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)第一电离能介于B、N之间的第二周期元素有3种.
(1)第一电离能介于B、N之间的第二周期元素有3种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com