
| A. | ①②③⑤ | B. | ①③⑤⑥⑦ | C. | 只有①⑦ | D. | ③⑥⑦ |
科目:高中化学 来源: 题型:选择题
| A. | 凡金属元素与非金属元素化合时都能形成离子键 | |
| B. | 非金属原子间不可能形成离子键 | |
| C. | 钠原子与氯原子通过得失电子,以离子键结合成氯化钠后体系能量降低 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-=4OH- | |
| B. | 以NaOH溶液为电解液时,负极反应为Al+4OH--3e-=AlO2-+2H2O | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH增大 | |
| D. | 以NaCl溶液为电解液时,电流由空气电极沿导线流向铝合金电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量的递增 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素原子的最外层电子排布呈周期性变化 | |
| D. | 元素的金属性和非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰融化时水分子中共价键发生断裂 | |
| B. | H2O2、PCl5都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、HI的酸性依次增强 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中只有离子键 | |
| B. | 非金属元素只能形成共价键 | |
| C. | 水分子中存在氢键,所以水的沸点较高 | |
| D. | 原子晶体的熔点不一定比金属晶体的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铁溶液和氢氧化钠溶液混合 | B. | 钠块投人水中 | ||
| C. | HCl和 NH3反应生成NH4Cl固体 | D. | 酸性 KMnO4溶液中通人 SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式为:CH3OCH3-12e-+12OH-═2CO2+8H2O | |
| B. | 二甲醚为不可再生能源 | |
| C. | 二甲醚分子中只含有极性键 | |
| D. | 二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-1455kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
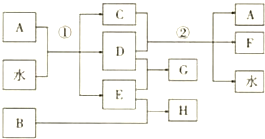
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com