
| A. | K+、Ca2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | MnO4-、NO3-、Na+、Cl- |
分析 无色溶液可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,强酸性溶液中存在大量氢离子,
A.钙离子与硫酸根离子反应生成硫酸钙沉淀;
B.碳酸氢根离子与氢离子反应生成二氧化碳气体和水;
C.四种离子之间不反应,都不与氢离子反应,且为无色溶液;
D.高锰酸根离子为有色离子.
解答 解:强酸性溶液中存在大量氢离子,溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.Ca2+、SO42-之间反应生成硫酸钙,在溶液中不能大量共存,故A错误;
B.HCO3-与氢离子反应,在溶液中不能大量共存,故B错误;
C.Cl-、Na+、NO3-、Ca2+之间不发生反应,都是无色离子,都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.MnO4-为有色离子,不满足溶液无色的条件,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在等.


科目:高中化学 来源: 题型:选择题
| A. | pH=4的NaHSO3溶液中:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>C(OH-) | |
| B. | 0.2mol•L-1Na2CO3溶液和0.1mol•L-1盐酸等体积混合,在混合溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 等体积、等浓度的HR溶液和NaOH溶液混合,溶液中一定存在:c(Na+)>c(R-)>c(OH-)>c(H+) | |
| D. | 等体积、等浓度的①CH3COONa②NaNO3③NaClO溶液中离子总数:②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 氢氧化钡溶液与硫酸反应:OHˉ+SO42-+Ba2++H+═H2O+BaSO4 | |
| C. | 二氧化硅与氢氧化钠溶液反应:SiO2+OHˉ═H2SiO3 | |
| D. | 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | -3、+5 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| C. | 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2- | |
| D. | 中性透明溶液:K+、Cl-、NO3-、Fe3+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、Cl-、NO3-等离子能在甲基橙试液显红色的溶液中共存 | |
| B. | K+、Mg2+、Cl-、I-等离子能在[H+]=10-12 mol•L-1的溶液中共存 | |
| C. | NaHS水解的离子方程式为:HS-+H2O?S2-+H3O+ | |
| D. | NaHCO3的电离方程式为:NaHCO3=Na++HCO3-,HCO3-?H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
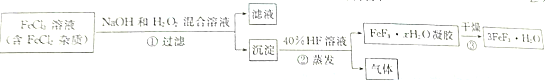
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | ||
| F |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应一定是反应物总能量大于生成物的总能量 | |
| B. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| C. | 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 | |
| D. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com