
| B | ||
| F |
分析 A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,则A为H元素;D是地壳中含量最多的元素,则D为O元素;E是地壳中含量最多的金属元素,则E为Al;B与氧元素能形成两种无色气体,原子序数小于氧,则B为碳元素;C的原子序数介于碳、氧之间,则C为N元素;由B、F在元素周期表中的相对位置,可知F为S元素,G的原子序数又大于硫,故G为Cl.
解答 解:A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,则A为H元素;D是地壳中含量最多的元素,则D为O元素;E是地壳中含量最多的金属元素,则E为Al;B与氧元素能形成两种无色气体,原子序数小于氧,则B为碳元素;C的原子序数介于碳、氧之间,则C为N元素;由B、F在元素周期表中的相对位置,可知F为S元素,G的原子序数又大于硫,故G为Cl.
(1)BF2为CS2,分子中碳原子与硫原子之间形成2对共用电子对,结构式为S=C=S,
故答案为:S=C=S;
(2)D和F的氢化物分别为H2O、H2S,H2O分子之间形成氢键,沸点高于H2S的,
故答案为:H2O;
(3)实验室制取Cl2气体的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)NH3的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,反应生成氮气与水,化学方程式为:2NH3•H2O+3H2O2=N2↑+8H2O,
故答案为:2NH3•H2O+3H2O2=N2↑+8H2O;
(5)SO2气体通入BaCl2和硝酸的混合溶液中,生成白色沉淀和无色气体,分别为硫酸钡与NO,有关反应的离子方程式为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+;
(6)火箭使用C2H8N2作燃料,N2O4为氧化剂,产生三种无污染的气体,生成氮气、二氧化碳与水,化学方程式为:C2H8N2+2N2O4=2CO2+3N2+4H2O,
故答案为:C2H8N2+2N2O4=2CO2+3N2+4H2O;
(7)20mL 0.5mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.02L×0.5mol/L=0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,12mL 2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.012L×2mol/L=0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022mol.
点评 本题考查结构位置性质关系、元素化合物性质、常用化学用语、化学计算,是对学生综合能力的考查,(7)中计算为难点、易错点,关键是明确离子反应先后顺序,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡在溶液中反应Ba2++SO42-═BaSO4↓ | |
| B. | 氢氧化镁溶于稀硫酸:2H++Mg(OH)2═Mg2++2H2O | |
| C. | 大理石与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 少量金属钠投入到CuSO4溶液中 2Na+Cu2+═2Na++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | MnO4-、NO3-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
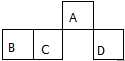 短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图.其中A原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:rD>rC>rB>rA | |
| B. | 含D元素的盐溶液一定显中性 | |
| C. | 氢化物的热稳定性:C>D | |
| D. | D的单质能与A形成的氢化物反应生成具有漂白性的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | |
| C | D |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
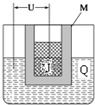
 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答:
已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答: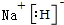
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com