
【题目】化学与生活密切相关,下列说法不正确的是( )
A.用来制造电线电缆的聚乙烯树脂属于热塑性高分子材料
B.研发可降解高分子材料,可以减少“白色污染”
C.棉、麻、羊毛及合成纤维完全燃烧都只生成![]() 和
和![]()
D.硅橡胶![]() 可由
可由![]() 经水解、缩聚两步反应制得
经水解、缩聚两步反应制得
科目:高中化学 来源: 题型:
【题目】峨眉金顶摄身崖又称舍身崖,因常现佛光而得名。“佛光”因摄入身之影像于其中,遂称“摄身光”,为峨眉胜景之一。摄生崖下土壤中富含磷矿,所以在无月的黑夜可见到崖下荧光无数。
(1)“荧光”主要成分是PH3,其结构式为___________,下列有关PH3的说法错误的是___________。
a.PH3分子是极性分子
b.PH3分子稳定性低于NH3分子,因为N-H键键能高
c.一个PH3分子中,P原子核外有一对孤电子对
d.PH3沸点低于NH3沸点,因为P-H键键能低
(2)“荧光”产生的原理是Ca3P2在潮湿的空气中剧烈反应,写出该反应的化学方程式____________________。
(3)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H | 白磷分子结构 |
键能/(kJ·mol-1) | 213 | 436 | 322 |
|
则反应4PH3(g)![]() P4(g)+6H2(g) △H=___________ kJ· mol-1。
P4(g)+6H2(g) △H=___________ kJ· mol-1。
(4)某温度下,向容积为2L的密闭容器中通入2 mol PH3发生(3)中反应,5min后反应达平衡,测得此时H2的物质的量为1.5 mol,则用PH3表示的这段时间内的化学反应速率v(PH3)=__________;下列说法能表明该反应达到平衡状态的是___________。
A.混合气体的密度不变 B.6v(PH3)=4v(H2)
C.c(PH3):c(P4):c(H2)=4:1:6 D.混合气体的压强不变
(5)PH3有毒,白磷工厂常用Cu2+、Pd2+液相脱除PH3:PH3+2O2![]() H3PO4,其他条件相同时,溶解在溶液中O2的体积分数与PH3的净化效率与时间的关系如图所示,回答下列问题:
H3PO4,其他条件相同时,溶解在溶液中O2的体积分数与PH3的净化效率与时间的关系如图所示,回答下列问题:
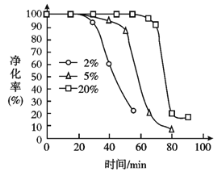
(I)由图可知,富氧有利于____________(选填“延长”或“缩短”)催化作用的持续时间。
(Ⅱ)随着反应进行,PH3的净化效率急剧降低的原因可能为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.常温下,![]() 的氢氧化钠溶液中加入10mL
的氢氧化钠溶液中加入10mL ![]() 的HA,所得溶液
的HA,所得溶液![]()
B.![]() 时,
时,![]() 与
与![]() 的氯化铵溶液的pH前者大
的氯化铵溶液的pH前者大
C.室温时浓度均为![]() 的
的![]() 和
和![]() 的混合液,pH为10,则
的混合液,pH为10,则![]()
D.![]() 溶液:
溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
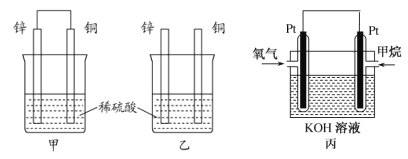
①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将n![]() 氨水滴入10mL
氨水滴入10mL![]() 盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是
盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是![]()
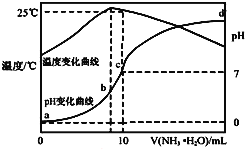
A.a点![]()
B.水的电离程度:![]()
C.b点:![]()
D.![]() 时
时![]() 水解常数为
水解常数为![]()
![]() 用n表示
用n表示![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时,各微粒浓度占总微粒浓度之和的分数
平衡时,各微粒浓度占总微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法正确的是
与pH的关系如图所示。下列说法正确的是![]()
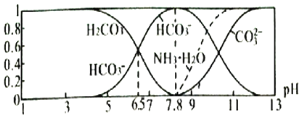
A.当![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
![]()
B.![]() 溶液中存在下列关系:
溶液中存在下列关系: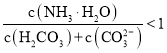
C.向![]() 的上述溶液中逐滴滴加氢氧化钠溶液时,
的上述溶液中逐滴滴加氢氧化钠溶液时,![]() 和
和![]() 浓度逐渐减小
浓度逐渐减小
D.分析可知,常温下水解平衡常数![]() 的数量级为
的数量级为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀工业上,为了提高镀锌的效果,通常采用Zn(CN)42-溶液代替Zn2+溶液进行电解。请回答下列问题:
(1)元素锌在周期表中的位置为_____________,基态Zn的价电子排布式为_____________。
(2)Zn(CN) 42-所含元素中,电负性最大的元素是_____________,Zn(CN) 42-中含有的化学键类型有σ键和_____________。
(3)CN-中C的杂化类型为_____________,与CN-互为等电子体的单质为_____________。
(4)H2CO3与HNO3的酸性相差较大,请解释其原因_____________。
(5)N和Al可组成一种新型半导体材料AlN;AlN具有耐高温,耐磨性能。其晶体类型为_____________,其晶体结构如图,已知晶胞边长为apm,则AlN的密度为_____________(用含a、NA的代数式表示)g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:
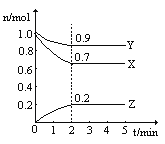
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com