
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH3③
2CO(g)+2H2(g) ΔH3③
则反应①自发进行的条件是___,ΔH3=___kJ·mol-1。
【答案】高温 +247.1
【解析】
根据△H-T△S判断反应的自发性;根据盖斯定律,将①-②得到反应③的热化学方程式。
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1,△H>0,△S>0,满足△H-T△S<0,则需要高温;水蒸气重整:CH4(g)+H2O(g)
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1,△H>0,△S>0,满足△H-T△S<0,则需要高温;水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①,CO(g)+H2O(g)
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1 ①,CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②,根据盖斯定律,将①-②得到反应③的热化学方程式:CH4(g)+CO2(g)
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②,根据盖斯定律,将①-②得到反应③的热化学方程式:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H3=(+205.9kJ·mol-1)-(-41.2kJ·mol-1)=+247.1kJ·mol-1,故答案为:高温;+247.1。
2CO(g)+2H2(g) △H3=(+205.9kJ·mol-1)-(-41.2kJ·mol-1)=+247.1kJ·mol-1,故答案为:高温;+247.1。


科目:高中化学 来源: 题型:
【题目】3,4-二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由化合物A制备该物质的合成路线如下:
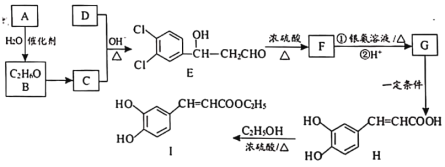
已知:R—CHO+R′—CH2—CHO![]()
![]()
回答下列问题:
(1)A的结构简式为___________。
(2)E生成F的反应类型为___________。
(3)下列有关H的说法中,不正确的是___________。
a.能使酸性高锰酸钾溶液褪色
b.1 mol H最多能和3 mol Br2反应
c.H分子中最多有9个碳原子共平面
d.l mol H分别与足量NaOH、NaHCO3反应时,消耗的NaOH、NaHCO3的物质的量之比为1:1
(4)写出C+D→E的化学方程式__________。
(5)已知W是H的同分异构体,符合下列条件的W结构共有________种。
①属于芳香族化合物。
②1 mol W与足量NaHCO3溶液反应生成气体44.8 L(标准状况)。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为:_________。
(6)季戊四醇(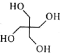 )是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A
)是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“>”“<”表示下列各组能级的能量高低。
Ⅰ.(1)4s___3d;
(2)钙是人体所需的重要元素之一,有一种补钙剂——抗坏血酸钙的组成为Ca(C6H7O6)2·4H2O,其结构示意图如下:
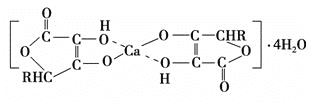
该物质中存在的化学键类型包括________(填字母)。
A.极性共价键 B.离子键 C.非极性共价键 D.配位键
Ⅱ.下列物质中:N2、H2O、Na2O、Ar、H2O2、KOH、NaF、Na2SO4
(1)只含有共价键的物质是______;
(2)只含有离子键的物质是______;
(3)既含有离子键,又含有共价键的物质______;
(4)不存在化学键的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂二次电池新正极材料的探索和研究对锂电池的发展非常关键。
(1) 锂硒电池具有优异的循环稳定性。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为__。
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:________________。充电时Li+向________(填“Se”或“Li”)极迁移。
③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是________。
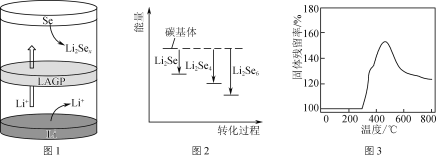
(2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
① Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是________。
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率=![]() ×100%)分析300 ℃后,固体残留率变化的原因是________。
×100%)分析300 ℃后,固体残留率变化的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(![]() )容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
)容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )

A.T1>T2
B.b点时二聚体的浓度为0.45mol·L-1
C.a点的正反应速率小于b点的逆反应速率
D.a点的反应速率小于c点的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池裝置如图所示,下列说法不正确的是( )
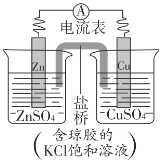
A.锌电极上发生反应:Zn-2e-=Zn2+
B.电子从锌片流向铜片
C.盐桥中K+移向ZnSO4溶液
D.理论上,当6.5gZn溶解时析出6.4gCu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL0.1mol/L的CH3COOH溶液中逐滴滴加0.1mol/L的NaOH溶液,溶液pH随NaOH溶液的体积变化如图所示。下列说法正确的是( )
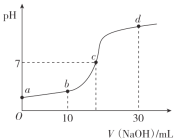
A.a点:pH=1
B.c点:V(NaOH)=20mL
C.b点:离子浓度的大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.a→d过程中,水电离出c(H+)不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、W、X、Y、Z是原子序数依次增大的短周期主族元素。R的最外层电子数是内层电子数的两倍,X2W2可用于呼吸面具,Y的主族序数与周期数相等,Z的氢化物的分子式为H2 Z。回答下列问题:
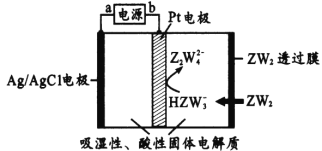
(1)Z在周期表中的位置是_____,Y的原子结构示意图_______。
(2)R2 Z的结构式是_______,X2 Z2的电子式是______。
(3)XYW2溶液呈____性(填“酸”、“碱”或“中”),原因是(用离子方程式表示)________。
(4)某传感器可以检测空气中ZW2的含量,工作原理如上图所示。则其阴极电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态As原子的价电子排布图为____________,基态Ga原子核外有________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的电负性比镓____(填“大”或“小”)。
(3)1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为_______
(5)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示, Ga与As以_______键键合。Ga和As的原子半径分别为a pm和b pm,设阿伏伽德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______________(列出计算式,可不化简)。
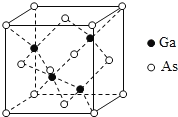
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com