
【题目】用“>”“<”表示下列各组能级的能量高低。
Ⅰ.(1)4s___3d;
(2)钙是人体所需的重要元素之一,有一种补钙剂——抗坏血酸钙的组成为Ca(C6H7O6)2·4H2O,其结构示意图如下:

该物质中存在的化学键类型包括________(填字母)。
A.极性共价键 B.离子键 C.非极性共价键 D.配位键
Ⅱ.下列物质中:N2、H2O、Na2O、Ar、H2O2、KOH、NaF、Na2SO4
(1)只含有共价键的物质是______;
(2)只含有离子键的物质是______;
(3)既含有离子键,又含有共价键的物质______;
(4)不存在化学键的是_______。
【答案】< ABCD N2、H2O、H2O2 Na2O、NaF KOH、Na2SO4 Ar
【解析】
Ⅰ.(1)根据构造原理,4s的能量小于3d,本题答案为:<;
(2)由图可知,其中含有离子键,极性共价键,非极性共价键和配位键(虚线表示),因此该物质中存在的化学键类型包括ABCD,本题答案为:ABCD;
Ⅱ. 非金属元素的原子之间通常形成共价键,不同种非金属元素原子之间通常形成极性共价键,同种非金属元素原子之间形成非极性共价键,活泼金属和活泼非金属元素之间易形成离子键。
N2、H2O、H2O2中只含有共价键;Na2O、NaF两种物质都是由简单的阴、阳离子所形成的离子键,它们只含离子键;Na2SO4、KOH中既含离子键、又含共价键,Ar为单原子分子,不存在化学键。
(1)只含有共价键的物质是N2、H2O、H2O2,故本题答案为:N2、H2O、H2O2;
(2)只含有离子键的物质是Na2O、NaF,故本题答案为:Na2O、NaF;
(3)既含有离子键,又含有共价键的物质KOH、Na2SO4,故本题答案为:KOH、Na2SO4;
(4)不存在化学键的是Ar,故本题答案为:Ar。


科目:高中化学 来源: 题型:
【题目】某兴趣小组利用索氏提取器,用石油醚做溶剂从花生仁中提取油脂,装置如图。石油醚的主要成分为戊烷和已烷的混合物,沸程为:30℃~60℃。下列说法错误的是
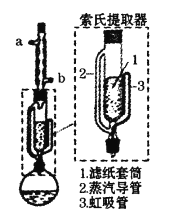
A.石油醚易挥发易燃烧,提取过程不可选用明火直接加热
B.石油醚的沸程较大,加热前不必加入沸石
C.烧瓶中的石油醚受热经侧管进入冷凝管,冷却后进入滤纸套筒与碎花生接触进行萃取
D.索氏提取器使用溶剂少,可循环连续萃取,萃取效率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究金属锌与氯化铜溶液之间反应,在实验中该同学观察到的现象有:
i.产生少量气泡;ii.有红色固体生成;iii.溶液中产生白色沉淀。
为了解释上述现象,某同学查阅资料,获得如下信息:
编号 | 化学反应离子方程式 |
1 | Zn+Cu2+ |
2 | Zn+2Cu2+ |
3 | Cu++2Cl- |
4 | Cu++Cl- |
(1)请结合离子方程式解释产生少量气泡的原因:___。
(2)Zn与CuCl2反应生成白色沉淀的离子方程式是___。
(3)为了探究影响生成白色沉淀的因素,该同学进一步实验。取不同浓度CuCl2溶液,加入锌并振荡,均立刻产生少量气泡和红色固体,其他实验现象如下。
| 编号 | 浓度(rnol/L) | 试剂(锌均过量) | 实验现象 |
a | 0.5 | 锌片 | 立刻出现少量白色沉淀 | |
b | 1 | 锌片 | 立刻出现白色沉淀 | |
1 | 锌粉 | 立刻出现大量白色沉淀 | ||
d | 1 | 锌片、适量NaCl固体 | 少量白色沉淀,振荡迅速溶解 |
①对比实验a、b,实验结论是___。
②某同学从化学平衡的角度分析,d中白色沉淀溶解可能的原因是___(用离子方程式表示)。为证明该同学分析的原因正确,向b试管中加入适量___,振荡,观察到___,证明该同学分析的原因正确。
(4)利用沉淀法除去杂质在实际生产中应用广泛。
①在工业中冶炼锌,为了除去ZnSO4电解液溶液中的C1-,可加入___和___,生成沉淀而除去。
②通过进一步查阅资料得知:CuCl的形成与溶液的pH及Cu2+等离子浓度有关,一定条件下,通过实验得出pH、Cu2+浓度对Cl-沉淀的影响如图所示:

根据图,除去该电解液中Cl-的最佳条件是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取![]() 的工艺流程如下:
的工艺流程如下:

(1)过程中可循环利用物质的电子式是_________________。
(2)步骤I“氨浸”时,控制温度为5055℃,pH约为9.5,含铜化合物转化为![]() 溶液。
溶液。
①CuO被浸取的离子方程式为_________________。
②浸取温度不宜超过55℃,其原因是_________________。
③Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(![]() )与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol
)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol![]() 全部浸出为
全部浸出为![]() (
(![]() 转变为
转变为![]() ,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。
,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。

(3)“除![]() ”时,加入的试剂是
”时,加入的试剂是![]() 和
和![]() 。
。
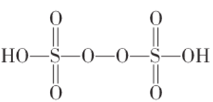
①已知![]() 结构式如图,根据此结构确定
结构式如图,根据此结构确定![]() 中S元素的化合价为_________________。
中S元素的化合价为_________________。
②![]() 需过量,一方面使
需过量,一方面使![]() 沉淀完全,另一目的是_________________。
沉淀完全,另一目的是_________________。
(4)“蒸氨”时发生反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3(砒霜)是两性氧化物(分子结构如图所示),溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AlH3。下列说法正确的是( )
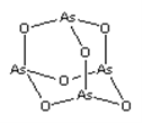
A.As2O3分子中As原子的杂化方式为sp2
B.LiAlH4为共价化合物,含有配位键
C.AsCl3空间构型为平面正三角形
D.AlH3分子键角大于109.5°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生仪器,C、D为气体净化装置(C中装有饱和食盐水,D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G中装有氢氧化钠溶液。
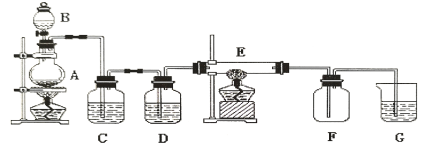
请回答下列问题:
(1)仪器A的名称是_________;B中盛装的药品是_____________;
(2)将实验室制氯气的化学方程式补充完整:MnO2+4HCl(浓)![]() ________ + Cl2↑+ 2H2O;
________ + Cl2↑+ 2H2O;
(3)C装置的作用是____________;D装置的作用是____________;
(4)E中发生化学反应的方程式为__________________;
(5)烧杯G中氢氧化钠溶液的作用是_______________;其发生反应的化学方程式为:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )

A.图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线
B.图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线
C.高温下能自发进行的反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
D.图4可表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH3③
2CO(g)+2H2(g) ΔH3③
则反应①自发进行的条件是___,ΔH3=___kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列方程式
(1)铝热反应冶炼金属铁的化学方程式:___。
(2)工业冶炼金属铝的化学方程式:___。
(3)铝片打磨后与氢氧化钠溶液反应的离子方程式:___。
(4)四氧化三铁与稀硝酸反应的离子方程式:___。
(5)向NH4Al(SO4)2溶液中滴加氢氧化钡溶液使SO![]() 恰好完全沉淀,写出反应的离子方程式:___。
恰好完全沉淀,写出反应的离子方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com