
 ,
, .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
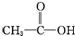 ②CH3CH2-OH ③H-OH ④
②CH3CH2-OH ③H-OH ④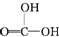 四种物质中羟基上氢原子的活泼性顺序.
四种物质中羟基上氢原子的活泼性顺序.| 编号 | 实验操作 | 实验现象 | 实验结论 |
| (1) | 分别取上述四种物质的少量溶液或液体于试管中,各滴入几滴石蕊试液 | ||
| (2) | 分别取适量①④的水溶液各加入少量 NaHCO3固体 | ||
| (3) | 分别取少量②③的液体各加入一小粒金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室将Na2SO3溶液直接加热蒸发结晶可得到Na2SO3晶体 |
| B、用湿润的pH试纸来检验溶液的pH值 |
| C、用KSCN溶液检验硫酸亚铁溶液是否氧化变质 |
| D、用四氯化碳萃取溴的苯溶液中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸和碱一定能发生中和反应 |
| B、同种元素的化合价越高氧化性一定越强 |
| C、某化合物如果不是电解质就一定是非电解质 |
| D、对于可逆反,温度升高则该反应的平衡常数一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自行车钢架生锈主要是电化学腐蚀所致 |
| B、玻璃容器内壁中沉积的CaSO4可用Na2CO3溶液浸泡后再加酸除去 |
| C、在工业合成氨中温度越高反应速度越快,越有利于提高N2的转化率 |
| D、生活中使用明矾净水,是利用了Al3+水解生成的Al(OH)3胶体吸附杂质的原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
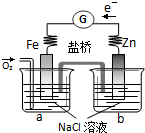
| A、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH升高 |
| C、烧杯b中发生的电极反应为Zn-2e-=Zn2+ |
| D、向烧杯a中加入少量K3Fe(CN)6溶液,有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甘油 | B、吗啡 | C、冰毒 | D、海洛因 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳的燃烧热大于110.5 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 180℃ |
| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com