

| A. | 图中,AB段的反应为Fe+2Fe 3+=3Fe 2+,溶液中溶质最终为FeSO 4 | |
| B. | 原溶液中H2SO4浓度为2.5mol•L -1 | |
| C. | 原混合溶液中NO3-的物质的量为0.4mol | |
| D. | 图中,OA段产生的气体是NO,BC段产生的气体是氢气 |
分析 由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,整个过程消耗22.4gFe,最终溶质为FeSO 4,根据Fe原子守恒计算n(FeSO 4),再根据硫酸根守恒可知n(H2SO4)=n(FeSO 4),进而计算硫酸的浓度.OA阶段NO3-完全反应,消耗Fe为11.2g,根据离子方程式计算每一份溶液中n(NO3-),可得原混合溶液中NO3-的物质的量.
解答 解:A.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故A正确;
B.整个过程消耗22.4gFe,最终溶质为FeSO 4,根据Fe原子守恒n(FeSO 4)=n(Fe)=$\frac{22.4g}{56g/mol}$=0.4mol,根据硫酸根守恒可知n(H2SO4)=n(FeSO 4)=0.4mol,每份溶液体积为100mL,所以硫酸的浓度是$\frac{0.4mol}{0.1L}$=4mol/L,故B错误;
C.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以每一份混合溶液中n(NO3-)=n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,故原混合溶液中NO3-为0.2mol×2=0.4mol,故C正确;
D.OA段产生的气体是NO,BC段产生的气体是氢气,故D正确.
故选:B.
点评 本题以图象为载体,考查有关金属和酸反应的计算题,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用,


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 随着核电荷数增加,碱金属单质的密度逐渐增大 | |
| B. | 随着核电荷数增加,卤素单质的熔沸点逐渐降低 | |
| C. | 随着核电荷数的增加,碱金属单质与水反应的剧烈程度增大 | |
| D. | 随着核电荷数增加,碱金属离子的氧化性逐渐增强,卤素离子的还原性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | 邻二甲苯只有一种结构可以证明苯分子中无单双健的交替结构 | |
| C. | CH2Cl2无同分异构体可以证明CH4是正四面体的结构 | |
| D. | 乙烯、乙炔是平面型分子,可知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子 | |
| B. | NH3和CH4的空间构型相似 | |
| C. | BF3与 都是平面型分子 都是平面型分子 | |
| D. | CO2和H2O都是直线型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验要求 | 实验方法 |
| 测定某工业废水的酸碱度 | |
| 检验自来水中残余氯分子 | |
| 检验CO2气体中含有的SO2 | |
| 除去FeCl2中的少量FeCl3 | |
| 除去NO中混有的少量NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4,8 | B. | 3,4,8 | C. | 2,3,9 | D. | 3,4,9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
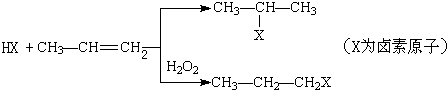

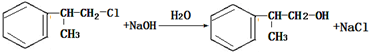
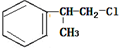 、
、 ;
;
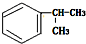 的一种同分异构体D符合以下条件:①苯环上有两条侧链 ②苯环上的一氯代物有2种,则D的结构简式为
的一种同分异构体D符合以下条件:①苯环上有两条侧链 ②苯环上的一氯代物有2种,则D的结构简式为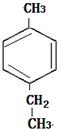 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列说法不正确的是( )
下列说法不正确的是( )| A. | 该原子的质量数为34 | B. | 该元素处于第四周期第ⅥA族 | ||
| C. | SeO2既有氧化性又有还原性 | D. | 酸性:HClO4>H2SeO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com