
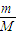 计算HCl的物质的量;
计算HCl的物质的量;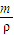 计算剩余溶液的体积,根据c=
计算剩余溶液的体积,根据c= 计算氢氧化钠的物质的量浓度.
计算氢氧化钠的物质的量浓度. =10bmol,故答案为:10b;
=10bmol,故答案为:10b; =5bmol,故电解生成的氯气为
=5bmol,故电解生成的氯气为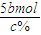 =
=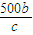 mol,利用氯原子守恒可知参加反应的n(NaCl)=2n(Cl2)=2×
mol,利用氯原子守恒可知参加反应的n(NaCl)=2n(Cl2)=2×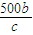 mol=
mol=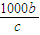 mol,故剩余的氯化钠为akg×23.4%-
mol,故剩余的氯化钠为akg×23.4%-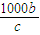 mol×58.5×10-3kg/mol=(0.234a-
mol×58.5×10-3kg/mol=(0.234a-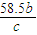 )kg,故答案为:(0.234a-
)kg,故答案为:(0.234a-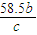 );
);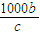 mol,剩余溶液的质量为akg-
mol,剩余溶液的质量为akg-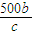 mol×(2×10-3kg/mol+71×10-3kg/mol)=(a-
mol×(2×10-3kg/mol+71×10-3kg/mol)=(a-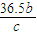 )kg,故剩余溶液的体积为
)kg,故剩余溶液的体积为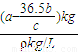 =
=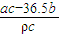 L,故氢氧化钠的物质的量浓度为
L,故氢氧化钠的物质的量浓度为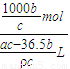 =
=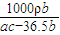 mol/L,故答案为:
mol/L,故答案为: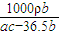 .
.

科目:高中化学 来源: 题型:
| 58.5b |
| c |
| 58.5b |
| c |
| 1000ρb |
| ac-36.5b |
| 1000ρb |
| ac-36.5b |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?丰台区一模)(1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.
(2012?丰台区一模)(1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.| 假设 | 主要操作 | 现象 | 结论 |
| 假设1: | |||
| 假设2:可能是H+与OH-中和,导致溶液褪色 |

查看答案和解析>>
科目:高中化学 来源:天津市青光中学2010-2011学年高一上学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com