
 某课外小组欲鉴定某硫酸钠样品中是否含有亚硫酸钠,设计方案如下:取少量固体配成溶液,往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色.如果溶液紫色褪去,说明该样品中含有亚硫酸钠.
某课外小组欲鉴定某硫酸钠样品中是否含有亚硫酸钠,设计方案如下:取少量固体配成溶液,往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色.如果溶液紫色褪去,说明该样品中含有亚硫酸钠.分析 (1)利用酸性KMnO4溶液的强氧化性将亚硫酸钠氧化成硫酸钠,而KMnO4溶液被还原成锰离子,结合得失电子守恒和电荷守恒及原子守恒书写;
(2)量筒刻度从下到上增大,滴定管刻度0刻度在上,从上到下增大,且最大刻度以下没有刻度,以此解答该题;
(3)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO4溶液应装在酸式滴定管中;KMnO4溶液呈紫色,滴入最后一滴Na2C2O4溶液,紫色褪去,说明滴定到终点;
②依据滴定消耗的Na2C2O4结合得失电子守恒计算剩余高锰酸钾的量,再根据高锰酸钾和亚硫酸根离子反应的定量关系计算得到;
(4)A.未用Na2C2O4标准液润洗滴定管,则导致滴定时消耗Na2C2O4体积偏大;
B.滴定前仰视盛有Na2C2O4溶液的滴定管,滴定后俯视,则导致滴定时消耗Na2C2O4体积偏小;
C.滴定前滴定管尖嘴处有气泡,滴定后消失,则导致滴定时消耗Na2C2O4体积偏大;
D.滴定时摇动锥形瓶,瓶中的液滴溅出,则导致滴定时消耗Na2C2O4体积偏小.
解答 解:(1)该反应原理为酸性KMnO4溶液的强氧化性将亚硫酸钠氧化成硫酸钠,而KMnO4溶液被还原成锰离子,离子方程式为:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O,故答案为:5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O;
(2)量筒小刻度在下,A与B,B与C刻度间相差10mL,刻度A为30,则刻度B为20,AB间每一小格为2mL,则量筒中液体的体积为22.0mL;
滴定管刻度0刻度在上,从上到下增大,图Ⅱ表示25mL滴定管中液面的位置.如果液面处的读数是a,且最大刻度以下没有刻度,则滴定管中液体的体积一定大于(25-a) mL,
故答案为:22.0;D;
(3)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO4溶液应装在酸式滴定管中;KMnO4溶液呈紫色,滴入最后一滴Na2C2O4溶液,紫色褪去,说明滴定到终点,故答案为:酸;紫色褪去且半分钟不恢复;
②用C2mol/L草酸钠(Na2C2O4)溶液滴定过量的KMnO4,至滴定终点时用去Na2C2O4溶液V2mL,根据得失电子守恒,则剩余高锰酸钾物质的量为$\frac{C{\;}_{2}V{\;}_{2}×10{\;}^{-3}×2}{7-2}$mol,所以与亚硫酸钠溶液反应消耗的高锰酸钾溶液为C1V1×10-3mol-$\frac{C{\;}_{2}V{\;}_{2}×10{\;}^{-3}×2}{7-2}$mol,依据反应的离子方程式:
2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,
2 5
C1V1×10-3mol-$\frac{C{\;}_{2}V{\;}_{2}×10{\;}^{-3}×2}{7-2}$mol $\frac{5}{2}$×(C1V1×10-3mol-$\frac{C{\;}_{2}V{\;}_{2}×10{\;}^{-3}×2}{7-2}$mol)=10-3×(2.5C1V1-C2V2)mol
故答案为:10-3×(2.5C1V1-C2V2);
(4)A.未用Na2C2O4标准液润洗滴定管,则导致滴定时消耗Na2C2O4体积偏大,所以计算出剩余高锰酸钾物质的量也就偏大,则与亚硫酸根离子反应的高锰酸钾偏小,导致测得的Na2SO3的物质的量偏小,故A错误;
B.滴定前仰视盛有Na2C2O4溶液的滴定管,滴定后俯视,则导致滴定时消耗Na2C2O4体积偏小,所以计算出剩余高锰酸钾物质的量也就偏小,则与亚硫酸根离子反应的高锰酸钾偏大,导致测得的Na2SO3的物质的量偏大,故B正确;
C.滴定前滴定管尖嘴处有气泡,滴定后消失,则导致滴定时消耗Na2C2O4体积偏大,所以计算出剩余高锰酸钾物质的量也就偏大,则与亚硫酸根离子反应的高锰酸钾偏小,导致测得的Na2SO3的物质的量偏小,故C错误;
D.滴定时摇动锥形瓶,瓶中的液滴溅出,则导致滴定时消耗Na2C2O4体积偏小,所以计算出剩余高锰酸钾物质的量也就偏小,则与亚硫酸根离子反应的高锰酸钾偏大,导致测得的Na2SO3的物质的量偏大,故B正确;
故选:BD.
点评 本题考查物质组成的推断,为高频考点,把握滴定法测定离子的浓度及误差分析为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
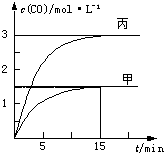 一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )| 容 器 | 甲 | 乙 | 丙 |
| 容 积 | 0.5L | 0.5L | V |
| 温 度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O | 1molCO 1molH2 | 4molC 2molH2O |
| A. | 甲容器中,反应在前15min的平均速率v(H2)=0.2mol•L-1•min-1 | |
| B. | 丙容器的体积V>0.5L | |
| C. | 当温度为T1℃时,反应的平衡常数K=4.5(mol•L-1) | |
| D. | 乙容器中,若平衡时n(H2O)=0.4mol,则T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S水解:S2-+2 H2O?H2S+2OH- | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 向次氯酸钙溶液通入过量CO2:Ca2++2CIO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2CIO-+H2O+SO2═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑤ | C. | ③④⑤⑥ | D. | ④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 说法1 | 说法2 | 判断 |
| A | Na+、Mg2+、O2-、F-中离子半径最大的是O2- | I的原子半径大于Br,HI比HBr的热稳定性强 | 说法1说法2均正确 |
| B | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | 热稳定性:HCl>HI | 说法1说法2均正确 |
| C | 原子半径:Na>Mg | 酸性:H2SO3>H2SO4 | 说法1说法2均错误 |
| D | 同主族元素的简单阴离子还原性越强,水解程度越大 | 同周期金属元素的化合价越高,其原子失电子能力越强 | 说法1错误说法2正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应时并不一定都伴随着能量变化 | |
| B. | 所有的燃烧反应都是放热反应 | |
| C. | 只要有能量变化的都是化学变化 | |
| D. | 任何反应中的能量变化都表现为热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 220 | 330 | 440 | 550 | 660 | 770 | 880 |
| 铜平均溶解速率(×10-3mol•L-1•min-1) | 77.34 | 88.01 | 99.25 | 77.98 | 77.24 | 66.73 | 55.76 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com