
【题目】下表列出了A~R九种元素在周期表的位置:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | R | F | |||||
3 | A | C | D | H | I | G | ||
4 | B |
(1)写出R单质分子的电子式____________。
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是_________________ (填化学式)
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为 __________________(用元素的离子符号表示)
(4)写出A的单质与水反应的化学方程式____________________
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g。X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应。
X的元符号是_______________,它位于元素周期表中______________________
【答案】 ![]() NaOH K+>Na+>Mg2+ 2Na + 2H2O =2NaOH +H2 ↑ Al 第3周期ⅢA族
NaOH K+>Na+>Mg2+ 2Na + 2H2O =2NaOH +H2 ↑ Al 第3周期ⅢA族
【解析】本题考查元素周期表和元素周期律的应用,(1)根据元素在周期表中位置,R为N,其单质为N2,两个氮原子共用三个电子对,电子式为:![]() ;(2)三种元素分别是Na、Mg、Al,金属性越强,其最高价氧化物的水化物碱性越强,同周期从左向右金属性减弱,因此最高价氧化物的水化物碱性大小是NaOH>Mg(OH)2>Al(OH)3,因此碱性最强的是NaOH;(3)简单离子是Na+、K+、Mg2+,电子层数越多,半径越大,K+有三个电子层,另外两个有两个电子层,因此K+半径最大,Na+、Mg2+核外电子层数相同,离子半径随着原子序数的增大而减小,因此离子半径大小顺序是K+>Na+>Mg2+;(4)A为Na,与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑;(5)X的氢氧化物表现两性,因此X为Al,位于第三周期第IIIA族。
;(2)三种元素分别是Na、Mg、Al,金属性越强,其最高价氧化物的水化物碱性越强,同周期从左向右金属性减弱,因此最高价氧化物的水化物碱性大小是NaOH>Mg(OH)2>Al(OH)3,因此碱性最强的是NaOH;(3)简单离子是Na+、K+、Mg2+,电子层数越多,半径越大,K+有三个电子层,另外两个有两个电子层,因此K+半径最大,Na+、Mg2+核外电子层数相同,离子半径随着原子序数的增大而减小,因此离子半径大小顺序是K+>Na+>Mg2+;(4)A为Na,与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑;(5)X的氢氧化物表现两性,因此X为Al,位于第三周期第IIIA族。


科目:高中化学 来源: 题型:
【题目】下列有关氯的说法不正确的是( )
A.氯气是由瑞典化学家舍勒首先制得B.氯气是由英国化学家戴维命名的
C.氯元素主要以单质的形式大量存在海水里D.氯气是一种重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一——黑火药,它的爆炸反应为2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)除S外,上列元素的电负性从大到小依次为________。
(2)在生成物中,A的晶体类型为________,含极性共价键的分子的中心原子轨道杂化类型为________。
(3)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H+、I-、Br2、Na+
B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42-
D.Cu2+、NH4+、Br-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨晶体结构中的某一种的某一部分。
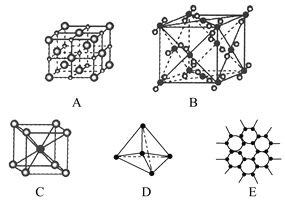
(1)其中代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)其中代表石墨的是_______,其中每个正六边形占有碳原子数平均为________个。
(3)其中代表NaCl晶体的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl晶体的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的前四周期,回答下列问题:
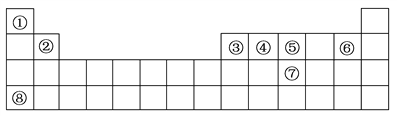
(1)按原子轨道的重叠方式,①与⑤形成的化合物中的共价键属于________(填“σ”或“π”)键。
(2)②、⑤、⑥、⑧四种元素第一电离能由高到低的顺序是________(用元素符号表示)。
(3)元素④形成的单质的晶体类型可以是原子晶体,如________(填写物质名称),也可以是________,如C60。
(4)元素③、⑥形成的化合物与⑦的氢化物均为AB3型,但这两种化合物分子的立体结构明显不同。③、⑥两种元素形成的化合物分子的立体结构为________,⑦的氢化物分子的立体结构为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在5种离子:NO3-、SO42-、Fe3+、H+和R离子,其物质的量之比为2:3:1:3:1,则R可能为
A. Ca2+ B. Mg2+ C. Cl- D. Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.为了制备氯气,某同学查阅资料发现实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)请用双线桥法对该反应进行标注________________。
(2)写出该反应的离子方程式________________。
(3)该反应中,氧化剂和还原剂之比是_________。
(4)草酸能使酸性KMnO4溶液褪色,配平下面的化学方程式:
_____KMnO4+____H2SO4+____H2C2O4 = ____MnSO4+_____K2SO4 +____CO2↑+____H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com