
【题目】锌猛干电池是日常生活中常用的一次电池。一种处理废旧干电池的流程如下:

下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. “水浸”后的滤渣干燥后经充分灼烧可回收其中的MnO2
C. “沉淀”反应后的滤液可通过蒸发至干回收NH4Cl
D. “沉淀”反应的离子方程式为:Zn2+ + 2NH3·H2O = Zn(OH)2↓ + 2NH4+
科目:高中化学 来源: 题型:
【题目】FeSO4 溶液放置在空气中容易变质,因此为了方便使用 Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)26H2O],它比绿矾或绿矾溶液更稳定。(稳定是指物质放置 在空气中不易发生各种化学反应而变质)
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是_______。向 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体。
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是_______,C 装置的作用是_______。
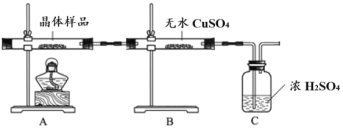
取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,_______ (填操作与现象),证明所制得的晶体中有 Fe2+。
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
(资料 1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释 FeSO4 溶液产生淡黄色浑浊的原因_______。
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2 溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:_______。
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,
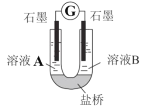
观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
序号 | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 电流计读数 |
实验1 | pH=1 | pH=5 | 8.4 |
实验2 | pH=1 | pH=1 | 6.5 |
实验3 | pH=6 | pH=5 | 7.8 |
实验4 | pH=6 | pH=1 | 5.5 |
(资料 2)原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原 电池的电流越大。
(资料 3)常温下,0.1mol/L pH=1 的 FeSO4 溶液比 pH=5 的 FeSO4 溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 型管中左池的电极反应式____________。
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为____________。
③对比实验____________和____________,还可得出在一定pH 范围内溶液酸碱性变化对 O2 氧化性强弱的影响因素。
④ 对(资料 3)实验事实的解释为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员最近发现了一种“水电池”,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池总反应式为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列对“水电池”在海水中放电时的有关说法正确的是( )
A.Ag发生还原反应
B.正极反应式为:5MnO2+2e-=Mn5O![]()
C.每生成1molAgCl转移2mol电子
D.工作时,电子由MnO2极经外电路流向Ag极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管新型二次电池的装置如图所示。下列说法中正确的是
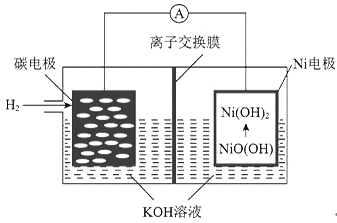
A. 离子交换膜选用阳离子交换膜(只允许阳离子通过) B. 正极的电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
C. 导线中通过1mol电子时,理论上负极区溶液质量增加1g D. 充电时,碳电极与电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:
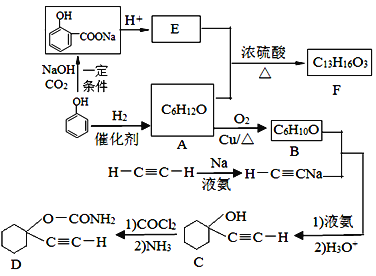
(1)A的化学名称是_________,C中含氧官能团的名称为_______________。
(2)F的结构简式为_______________,A和E生成F的反应类型为_______________。
(3)B与乙炔钠合成C的反应类型(酸化前)是______________;写出由C合成D的第二个反应的化学方程式___________________________________。
(4)同时满足下列条件的E的同分异构体有__________种(不含立体异构)。
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
(5)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数为NA,下列叙述正确的是( )
A.10g氖气所含原子数为NA
B.在D218O中,质量数之和是质子数之和的两倍
C.28g由C2H4和C3H6组成的混合物中,H原子的数目为4NA
D.标况下22.4L正戊烷含氢原子数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃的结构简式为:![]() ,有甲、乙、丙、丁四位同学分别将其命名为:2-甲基-4-乙基-4-戊烯;2-异丁基-1-丁烯;2,4-二甲基-3-己烯;4-甲基-2-乙基-1-戊烯,下面对4位同学的命名判断正确的是
,有甲、乙、丙、丁四位同学分别将其命名为:2-甲基-4-乙基-4-戊烯;2-异丁基-1-丁烯;2,4-二甲基-3-己烯;4-甲基-2-乙基-1-戊烯,下面对4位同学的命名判断正确的是
A. 甲的命名主链选择是错误的
B. 乙的命名对主链碳原子的编号是错误的
C. 丙的命名主链选择是正确的
D. 丁的命名是正确的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为,苯分子的结构中碳碳间以单、双键交替排列结合成环状。为了验证凯库勒的观点,某同学设计了以下实验方案:

①按如图所示的装置连接好仪器;
②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量FeBr3,塞上橡皮塞,打开止水夹K1、K2、K3;
④待烧瓶a中收集满气体后,将导管b的下端插入烧杯D里的水中,挤压预先盛有水的胶头滴管,观察实验现象。
(1)A中所发生反应的反应类型为________,能证明凯库勒观点错误的实验现象是________________________________________________________________。
(2)装置B的作用是___________________________________。
(3)装置A中发生反应的化学方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度时:2SO2(g)+O2(g)![]() 2SO3(g),当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2mol SO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是
2SO3(g),当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2mol SO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是
A.Q=197 kJ B.Q<197×2 kJ C.Q<197 kJ D.Q>197 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com