
【题目】化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,已知:Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数。回答下列问题:
(1)写出CH3COONa水解的离子方程式______。
(2)该缓冲溶液中除水分子外,所有粒子浓度由大到小的顺序______。
(3)25℃时,Ka(CH3COOH)______Kb(CH3COO-)(填“>”、“<”或“=”)。
(4)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是______(填写选项字母)。
a.代谢产生的H+被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H2CO3中和转化为HCO3-
【答案】CH3COO-+H2OCH3COOH+OH- c(CH3COO-)>c(Na+)>c(H+)>c(OH-) > ac
【解析】
(1)CH3COONa水解生成醋酸和NaOH;
(2)可以根据CH3COOH和CH3COONa的缓冲溶液,pH=4.76,呈酸性,结合电荷守恒分析解答;
(3)浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,说明醋酸电离程度大于醋酸钠水解程度,也可以计算出Kb再判断;
(4)H2CO3(CO2)与NaHCO3的缓冲体系中H2CO3(CO2)能中和人体代谢产生的少量碱,同时NaHCO3又可吸收人体代谢产生的少量H+,有效除掉人体正常代谢产生的酸或碱,保持pH的稳定,据此分析解答。
(1)CH3COONa水解生成醋酸和NaOH,离子方程式为CH3COO-+H2OCH3COOH+OH-,故答案为:CH3COO-+H2OCH3COOH+OH-;
(2) 0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,呈酸性,即c(H+)>c(OH-),以醋酸的电离为主,电荷守恒为c(H+)+c(Na+)=c(OH-)+c(CH3COO-),所以溶液中离子浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(3)浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液呈酸性,说明CH3COOH的电离程度大于CH3COONa的水解程度,即Ka(CH3COOH)>Kb(CH3COO-),实际上Kb=![]() =
=![]() =
=![]() ×10-9,故答案为:>;
×10-9,故答案为:>;
(4)a.人体血液中存在H2CO3H++HCO3-平衡,人体代谢产生的H+与HCO3-结合形成H2CO3,随血液带到肺部分解生成二氧化碳和水,故a正确;b.血液中的缓冲体系可抵抗少量酸或碱的影响,不能抵抗大量酸或碱的影响,否则缓冲溶液失去作用、出现酸或碱中毒,故b错误;c.代谢产生的碱性物质进入血液时,立即被H2CO3中和成HCO3-,经过肾脏调节排除体外,同时H+又可由H2CO3电离补充,维持血液pH的稳定,故c正确;故答案为:ac。


科目:高中化学 来源: 题型:
【题目】下列各组反应中关于能量的比较正确的是( )
①CH3OH(g)+O2(g)=CO (g)+2H2O(l) △H1;CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H2; △H1<△H2
②2H2O(l) =2H2(g)+O2(g) △H1; 2Na(s)+2H2O(l) =2NaOH(aq)+H2(g) ΔH2; △H1>△H2
③H2(g)+Cl2(g)=2HCl(g) △H1; ![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl (g) △H2; △H1>△H2
Cl2(g)=HCl (g) △H2; △H1>△H2
④t ℃时,在一定条件下,将 1 mol N2和 3 mol H2 分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为 Q1、Q2 ; Q1<Q2
A.①③B.②④C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示:
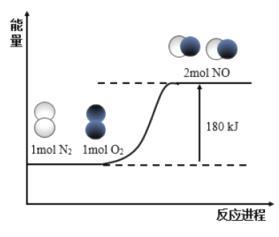
已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。下列说法正确的是
A.断开1mol NO(g)中化学键需要吸收632kJ能量
B.NO(g)=![]() N2(g)+
N2(g)+![]() O2(g) H=+90kJ/mol
O2(g) H=+90kJ/mol
C.N2(g)+O2(g)=2NO(g) H=-180kJ/mol
D.形成1mol NO(g)中化学键时释放90kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种淡黄色粉末,易溶于水,不溶于乙醇。在实验室制备连二亚硫酸钠流程如下:
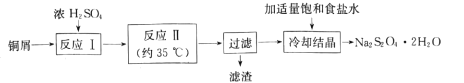
(1)反应Ⅰ是制备SO2,下图装置可制取纯净干燥的SO2:
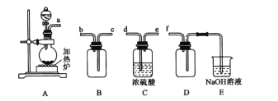
①按气流方向连接各仪器接口,顺序为a→ ___→f,装置D的作用是______。
②装置A中反应的化学方程式为___。
(2)反应Ⅱ所用实验装置如图所示(部分装置省略)。
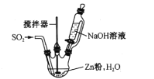
①通SO2之前先强力搅拌,将锌粉和水制成悬浊液,其目的是_________;控制反应温度的方法是____
②反应Ⅱ的离子方程式为 ___。
(3)“滤渣”经洗涤、灼烧,可得到一种工业产品是____(填化学式);加入适量饱和食盐水的目的是 ___。
(4)产品Na2S2O42H2O久置空气中易被氧化,其氧化产物可能是_______(写2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八角油是良好的天然香料和食品调料,其主要成分茴香脑的结构简式如图所示。下列关于苗香脑的说法错误的是
![]()
A.难溶于水,易溶于乙酸乙酯
B.属于烃的衍生物,与![]() 互为同系物
互为同系物
C.1mol 该分子最多能与4mol H2发生加成反应
D.使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的表达式正确的是
A. 乙炔分子的比例模型示意图:![]()
B. 2-甲基-2-戊烯的键线式:![]()
C. ![]() 的名称:3-甲基-1-丁烯
的名称:3-甲基-1-丁烯
D. 1,3-丁二烯的分子式:C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数)。请回答下列问题:
(1)下列关于烃A和烃B的说法不正确的是__填序号。
a.烃A和烃B可能互为同系物
b.烃A和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃
d.当n=11时,烃B可能的分子式有2种
(2)若烃A为链烃,且分子中所有碳原子都任同一条直线上,则A的结构简式为__。
(3)若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1molA最多可与1molH2加成,则A的名称是__。
(4)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量的浓硫酸,浓硫酸的质量增加1.26g,再通过足量的碱石灰,碱石灰的质量增加4.4g,则烃B的分子式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治疗帕金森病的新药沙芬酰胺的合成方法如下:

已知:
①CH3CN 在酸性条件下可水解生成 CH3COOH。
②CH2=CH-OH 和 CH3OOH 均不稳定。
(1)C 生成 D 的反应类型为_______________。G中含氧官能团的名称为_____。B 的名称为_____。
(2)沙芬酰胺的结构简式为_____。
(3)写出反应(1)的方程式_____。分析反应(2)的特点,写出用福尔马林浸制生物标本的反应原理的方程式_____(蛋白质的结构用![]() 表示)。
表示)。
(4)H 是 F 相邻的同系物,H 的苯环上有两个处于对位的取代基,符合下列条件的 H 的稳定的同分异构体共有_____种。
①苯环上仍然有两个处于对位的取代基;
②能与 NaOH 溶液反应;
(5)下图是根据题中信息设计的由丙烯为起始原料制备 B 的合成路线,在方框中补全必要的试剂和中间产物的结构简式(无机试剂任选,氧化剂用[O]表示,还原剂用[H]表示,连 续氧化或连续还原的只写一步)。________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中加入浓度均为0.2 mol·L1的CO和H2O, T℃发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
CO2(g)+H2(g)。下列说法能充分说明该反应已经达到化学平衡状态的是
A.单位时间内消耗1 mol CO同时生成1 mol CO2
B.混合气体的密度不再变化
C.CO、H2O、CO2和H2 的浓度不再变化
D.混合气体的平均摩尔质量不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com