
【题目】八角油是良好的天然香料和食品调料,其主要成分茴香脑的结构简式如图所示。下列关于苗香脑的说法错误的是
![]()
A.难溶于水,易溶于乙酸乙酯
B.属于烃的衍生物,与![]() 互为同系物
互为同系物
C.1mol 该分子最多能与4mol H2发生加成反应
D.使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同
科目:高中化学 来源: 题型:
【题目】荣获2019年诺贝尔化学奖的吉野彰是最早开发具有商业价值的锂离子电池的日本科学家,他设计的可充电电池的工作原理示意图如图所示。该可充电电池的放电反应为LixCn+Li(1-x)CoO2=LiCoO2+nC。NA表示阿伏伽德罗常数的值。下列说法错误的是( )
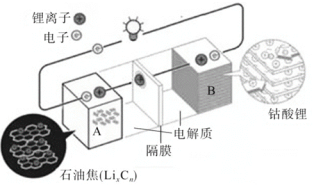
A.该电池用于电动汽车可有效减少光化学烟雾污染
B.充电时,阳极反应为LiCoO2xe=Li(1-x)CoO2+xLi+
C.充电时,Li+由A极移向B极
D.若初始两电极质量相等,当转移2NA个电子时,两电极质量差为14g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是一种有机高分子,其合成路线如下:
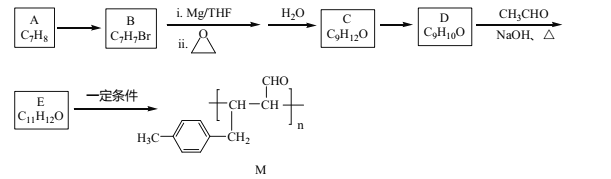
已知:①R-Br![]()
![]() R-CH2CH2OH
R-CH2CH2OH
②R-CHO![]() R-CH=CHCHO
R-CH=CHCHO
回答下列问题:
(1)A→B的反应试剂及条件是_______________。
(2)C→D的反应类型是_______________。
(3)化合物C的名称是_____________。
(4)D与银氨溶液反应的化学方程式为__________。
(5)E中官能团的名称是_______。
(6)化合物X(C10H10O)是E的同系物,且苯环上只有两个取代基,则X的同分异构体有______种,其中核磁共振氢谱为六组峰,峰面积之比为3:2:2:1:1:1的结构简式为________。
(7)设计由CH3Cl、环氧乙烷和乙醛制备CH3CH2CH=CHCHO的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于室温下pH=2的盐酸和0.01molL-1的醋酸溶液,下列说法正确的是( )
A.两溶液中溶质的物质的量:n(CH3COOH)=n(HCl)
B.两溶液中阴离子的浓度:c(CH3COO-)<c(Cl-)
C.相同体积的两溶液均用水稀释100倍后,盐酸的pH比醋酸的大
D.相同体积的两溶液分别与足量镁条反应,盐酸产生的气体比醋酸的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
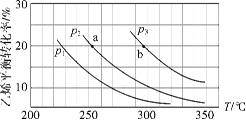
A.乙烯气相直接水合反应的H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =![]()
D.达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有25℃时,浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,已知:Ka(CH3COOH)=1.75×10-5,Kb为盐的水解常数。回答下列问题:
(1)写出CH3COONa水解的离子方程式______。
(2)该缓冲溶液中除水分子外,所有粒子浓度由大到小的顺序______。
(3)25℃时,Ka(CH3COOH)______Kb(CH3COO-)(填“>”、“<”或“=”)。
(4)人体血液存在H2CO3(CO2)与NaHCO3的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是______(填写选项字母)。
a.代谢产生的H+被HCO3-结合形成H2CO3
b.血液中的缓冲体系可抵抗大量酸、碱的影响
c.代谢产生的碱被H2CO3中和转化为HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氯代烃中不能由烯烃与氯化氢加成直接得到的有( )
A. 2一乙基—4—氯—1—丁烯 B. 氯代环己烷
C. 2,2,3,3—四甲基—1—氯丁烷 D. 3一甲基—3—氯戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于炔烃的说法中正确的是
A.分子中的碳原子不可能在同一直线上
B.分子中碳碳三键中的三个键的性质完全相同
C.分子组成符合CnH2n—2(n≥2)的链烃一定是炔烃
D.随着碳原子数增加,分子中碳的质量分数逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:I.CO2(g)+H2(g)![]() H2O(g)+CO(g) △H1=+41.1kJ/mol
H2O(g)+CO(g) △H1=+41.1kJ/mol
II.CO(g)+2H2(g)![]() CH3OH(g) △H2=-90.0kJ/mol
CH3OH(g) △H2=-90.0kJ/mol
写出CO2催化氢化合成甲醇的热化学方程式:________。
(2)为提高CH3OH的产率,理论上应采用的条件是________(填选项字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由CO2(g)催化氢化合成 CH3OH(g),不同投料比[n(H2)/n(CO2)]时某反应物X的平衡转化率变化曲线如图所示。反应物X是_______(填“CO2”或“H2”),判断依据是_______。
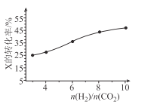
(4)250℃时,在体积为2.0 L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂发生 CO2催化氢化合成甲醇的反应,10 min时反应达到平衡,测得c(CH3OH) = 0.75 mol L-1。
①前10 min内的平均反应速率H2=_______ mol L-1 min-1。
②该温度下,该反应的化学平衡常数K =_______。
③催化剂和反应条件与反应物转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如下表所示:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为________(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com