
【题目】某化学兴趣小组设计如下两个实验证明:①氧化性:Fe3+>I2,②反应2Fe3++2I-=2Fe2++I2为可逆反应,下列说法中错误的是
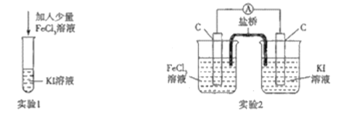
A.实验1试管中加入淀粉后溶液变蓝,该条件下氧化性:Fe3+>I2
B.实验2中最后电流表指针不再偏转可证明上述反应为可逆反应
C.实验1反应结束后,向试管中加入KSCN能判断该反应是否为可逆反应
D.实验2电流表指针不再偏转时,向右侧烧杯中加入单质碘可判断该反应是否为可逆反应
【答案】B
【解析】
A. 实验1试管中加入淀粉后溶液变蓝,说明生成了碘单质,发生了反应2Fe3++2I-=2Fe2++I2,则该条件下氧化性:Fe3+>I2,故A正确;
B. 若不是可逆反应,反应进行完全时,电流表指针不再偏转;若为可逆反应,反应达到平衡状态时,电流表指针也不再偏转,故实验2中最后电流表指针不再偏转不可证明上述反应为可逆反应,故B错误;
C. Fe3+的量是少量的,若不是可逆反应,则应反应完全,向试管中加入KSCN,溶液不会变红;若为可逆反应,Fe3+不会完全反应,向试管中加入KSCN,溶液变红,所以可以通过溶液是否变红判断是否有Fe3+,从而判断该反应是否为可逆反应,故C正确;
D. 若为可逆反应,当实验2电流表指针不再偏转时,向右侧烧杯中加入单质碘,碘单质的浓度增大,可逆反应2Fe3++2I-=2Fe2++I2逆向移动,电流表指针会发生偏转;若不是可逆反应,电流表指针不会发生偏转,故实验2电流表指针不再偏转时,向右侧烧杯中加入单质碘可判断该反应是否为可逆反应,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】2019 年诺贝尔化学奖授予英国科学家古德纳夫及另外两位科学家,以表彰他们在锂离子电池研究中的杰出贡献。 LiFePO4是用于制备大功率锂离子电池的正极材料 ,且一种制备流程如下:
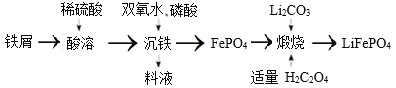
下列有关说法不正确的是
A.LiFePO4中Fe的化合价为+2
B.“沉铁”过程中双氧水作氧化剂
C.料液可循环利用
D.“煅烧”中有大量的CO2 、CO生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.25℃时,测得0.1mol/L的一元碱MOH溶液pH=11,则MOH一定为弱碱
B.25℃时,将pH=1的H2SO4溶液加水稀释10倍,所得溶液的c(SO42-)为0.005mol/L
C.25℃时,将![]() 的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
D.25℃时,pH=12的一元碱MOH溶液与pH=2的盐酸等体积混合,所得溶液pH≤7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NOx等污染物,减少汽车尾气污染是重要研究课题。
(1)已知: N2(g) + O2(g)==2NO(g) △H=+ 180.5kJ·mol-1
2C(s)+ O2(g)== 2CO(g) △H= - 221.0kJ·mol-1
C(s)+ O2(g)==CO2(g) △H= -393.5 kJ·mol-1
2CO(g)+ 2NO(g)== N2(g)+ 2CO2(g) △H=_______kJ·mol-1
(2)某温度下,为探究2CO(g)+ 2NO(g)N2(g)+ 2CO2(g)的反应速率,用气体传感器测得不同时间的CO和NO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO)/10-4mol·L-1 | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
c(NO)/10-4mol·L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
①前2s内,上述反应的平均反应速率v(NO)=_______;
②该温度下,上述反应的平衡常数K=_________;
③对于上述反应,下列叙述正确的是________(填字母)。
A.反应在低温下能自发进行 B.当2v正(CO)=v逆(N2)时,反应达到平衡状态
C.研究反应的高效催化剂意义重大 D.反应达到平衡时,CO、NO的转化率相等
(3)CO浓度分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。写出多孔电极a的电极反应式:_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸( )极易溶于水,且在水中会逐渐水解得到硫酸和过氧化氢:H2S2O8+H2O=H2SO4+H2SO5、H2SO5+H2O=H2SO4+H2O2,下列说法中错误的是
)极易溶于水,且在水中会逐渐水解得到硫酸和过氧化氢:H2S2O8+H2O=H2SO4+H2SO5、H2SO5+H2O=H2SO4+H2O2,下列说法中错误的是
A.过二硫酸与高锰酸钾溶液反应可产生氧气
B.过二硫酸铵溶于水所得溶液显酸性
C.将过二硫酸加入滴有紫色石蕊试液的水中,溶液显红色
D.过二硫酸可用来除去稀硫酸中的亚硫酸杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)在常温常压下为有臭鸡蛋气味的无色气体,广泛应用于农药、医药和其他化工生产中,存在于煤、石油和天然气中的羰基硫会腐蚀设备、污染环境,更会危害人体健康,工业上处理羰基硫常见的方法有水解反应和氢解反应。
(1)已知羰基硫中所有原子最外层均达到8电子结构,则其结构式为________________。
(2)①已知:H2(g)+COS(g)![]() H2S(g)+CO(g)△H1=+6.2kJ·mol-1;
H2S(g)+CO(g)△H1=+6.2kJ·mol-1;
②H2(g)+CO2(g)![]() H2O(g)+CO(g)△H2=+41.2kJ·mol-1;
H2O(g)+CO(g)△H2=+41.2kJ·mol-1;
则COS水解反应的热化学方程式为H2O(g)+COS(g)=H2S(g)+CO2(g),△H=___________kJ/mol.
②已知:COS水解反应的机理如下,其中吸附在催化剂表面的物种用*标注。
a. 吸附:H2O→H2O*
b. 反应:COS+H2O*→CO2+H2S*
c. 脱附:H2S*→H2S
已知COS水解反应的反应速率由b决定,则a、b、c三步中活化能最大的是__________________。
(3)已知COS氢解反应的热化学方程式为H2(g)+COS(g)![]() H2S(g)+CO(g) △H=+6.2kJ·mol-1,一定温度下,向某恒容密闭容器中充入4molCOS(g)和6molH2(g)发生氢解反应,H2、COS的体积分数
H2S(g)+CO(g) △H=+6.2kJ·mol-1,一定温度下,向某恒容密闭容器中充入4molCOS(g)和6molH2(g)发生氢解反应,H2、COS的体积分数![]() 随时间变化的关系如图所示,
随时间变化的关系如图所示,
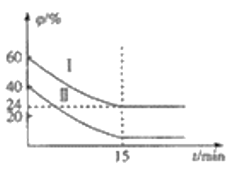
①H2的平衡转化率为_________________,
②该温度下,反应的平衡常数K为__________________,
③其他条件不变,20min时,向该容器中充入2molH2和3molCO,此时v(正)______________v(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 124 g P4含有P—P键的个数为4NA B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA D. 60gSiO2中含Si—O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。
(1)Ti的基态原子的电子排布式为________。
(2)已知TiC在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原TiO2制取TiC: TiO2+3C![]() TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
(3)钛的化合物TiCl4,熔点为-24℃,沸点为136.4℃,常温下是无色液体,可溶于甲苯和氯代烃。
①固态TiCl4属于________晶体,其空间构型为正四面体,则钛原子的杂化方式为__________。
②TiCl4遇水发生剧烈的非氧化还原反应,生成两种酸,反应的化学方程式为_________
③用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2·H2O.该配合物中含有化学键的类型有_________、__________。
(4)钛的一种氧化物是优良的颜料,该氧化物的晶胞如右图所示:

该氧化物的化学式为________;在晶胞中Ti原子的配位数为_______,若晶胞边长为a nm,NA为阿伏伽德罗常数的数值,列式表示氧化钛晶体的密度:___________g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com