
【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
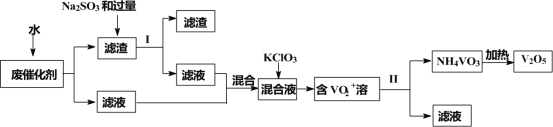
已知:①部分含钒物质常温下在水中的溶解性如表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
②VO2++2OH-![]() VO3-+H2O
VO3-+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为____________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为____________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为____________。
(5)在第Ⅱ步中需要加入氨水,请结合化学用语,用平衡移动原理解释加入氨水的一种作用为____________。
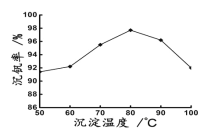
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请结合如图解释在第Ⅱ步中温度超过80°C以后,沉钒率下降的可能原因是____________;____________(写两条)。
(7)该工艺流程中可以循环利用的物质为____________。
(8)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L1(NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2mol·L1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO4-被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g·mol1)的质量分数是____________。(列出计算式)
【答案】粉碎废钒;搅拌;适当升温 (任意答一条正确措施) VO2+ V2O5+Na2SO3+2H2SO4===2VOSO4+Na2SO4+2H2O 6VO2++ClO3-+ 3H2O=== 6VO2++ Cl-+ 6H+ 作用1:溶液中存在平衡: VO2++2OH-![]() VO3-+H2O,加入氨水,使OH-浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3- 或作用2:溶液中存在平衡:NH4VO3(s)
VO3-+H2O,加入氨水,使OH-浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3- 或作用2:溶液中存在平衡:NH4VO3(s) ![]() NH4+ (aq)++VO3—(aq), 加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出(任意答出一种作用) 原因1:温度升高,NH4VO3溶解度增大,沉钒率下降或原因2:温度升高,氨水受热分解逸出溶液,使NH4+浓度下降,沉钒率下降 原因3:温度升高,氨水受热分解逸出溶液,使OH-浓度下降,VO2++2OH-
NH4+ (aq)++VO3—(aq), 加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出(任意答出一种作用) 原因1:温度升高,NH4VO3溶解度增大,沉钒率下降或原因2:温度升高,氨水受热分解逸出溶液,使NH4+浓度下降,沉钒率下降 原因3:温度升高,氨水受热分解逸出溶液,使OH-浓度下降,VO2++2OH-![]() VO3-+H2O,该平衡逆移,导致VO3-浓度下降,沉钒率下降或原因4:平衡VO2++2OH-
VO3-+H2O,该平衡逆移,导致VO3-浓度下降,沉钒率下降或原因4:平衡VO2++2OH-![]() VO3-+H2O,正反应可能是放热反应,温度升高,该平衡逆移,导致VO3-浓度下降,沉钒率下降。(任意答出2种原因) 氨水或NH3和H2O
VO3-+H2O,正反应可能是放热反应,温度升高,该平衡逆移,导致VO3-浓度下降,沉钒率下降。(任意答出2种原因) 氨水或NH3和H2O ![]()
![]() 100%
100%
【解析】
生产流程:废钒催化剂(主要成分含有V2O5、VOSO4、不溶性硅酸盐),据物质的水溶性确定,V2O5难溶于水,即为得到的滤渣亚硫酸根具有还原性,酸性条件下,能被五氧化二钒氧化生成硫酸根离子,离子反应方程式为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O,过滤得到滤渣为不溶性硅酸盐,强酸性浸出液含有VO2+、Na+、SO42-,氯酸钾具有氧化性,能将VO2+氧化为VO2+,加入氨水,调节溶液pH到最佳值,得到NH4VO3,最后焙烧得到五氧化二钒即可,以此解答。
(1)水浸时,为了提高废钒的浸出率,除了粉碎,还可以采取的措施搅拌、适当升高温度、延长浸泡时间等措施;
(2)VOSO4和(VO2)2SO4能够溶解在水中,故滤液1中钒的存在形式是:VO2+;V2O5和NH4VO3在水中不溶解,存在于滤渣中,加入Na2SO3,V2O5作氧化剂,SO32-作还原剂,反应的离子方程式为V2O5+SO32-+4H+=2VO2++SO42-+2H2O,滤液2中钒的存在形式是:VO2+;
(3)依题意,在滤渣1中加入Na2SO3和过量H2SO4溶液,V2O5作氧化剂,SO32-作还原剂,反应的离子方程式为V2O5+SO32-+4H+=2VO2++SO42-+2H2O;
(4) VO2+和KClO3反应中,生成物为VO2+,VO2+中V化合价升高做还原剂,KClO3中Cl化合价降低做氧化剂,已知消耗1molKClO3时转移6mol电子,可知KClO3中Cl元素化合价降低为-1价,则离子方程式为:6VO2++ClO3-+3H2O=== 6VO2++Cl-+6H+;
(5)溶液中存在平衡: VO2++2OH-![]() VO3-+H2O,氨水呈碱性,加入氨水,使OH-浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-或者溶液中存在平衡: NH4VO3(s)
VO3-+H2O,氨水呈碱性,加入氨水,使OH-浓度增大,该平衡正移,从而使VO2+尽可能都转化为VO3-或者溶液中存在平衡: NH4VO3(s)![]() NH4+ (aq)+ +VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出;
NH4+ (aq)+ +VO3-(aq),加入氨水,使NH4+浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出;
(6)温度越高,物质的溶解度越大,所以温度升高,NH4VO3溶解度增大,沉钒率下降或温度升高,氨气容易溢出,氨水受热分解逸出溶液,使OH-浓度下降,VO2++2OH-![]() VO3-+H2O,该平衡逆移,导致VO3-浓度下降,沉钒率下降;温度升高,氨水受热分解逸出溶液,使OH-浓度下降,VO2++2OH-
VO3-+H2O,该平衡逆移,导致VO3-浓度下降,沉钒率下降;温度升高,氨水受热分解逸出溶液,使OH-浓度下降,VO2++2OH-![]() VO3-+H2O,该平衡逆移,导致VO3-浓度下降,沉钒率下降或针对平衡:VO2++2OH-
VO3-+H2O,该平衡逆移,导致VO3-浓度下降,沉钒率下降或针对平衡:VO2++2OH-![]() VO3-+H2O,正反应可能是放热反应,温度升高,该平衡逆移,导致VO3-浓度下降,沉钒率下降;
VO3-+H2O,正反应可能是放热反应,温度升高,该平衡逆移,导致VO3-浓度下降,沉钒率下降;
(7)该流程中需要加入氨水沉钒,最后一步加热NH4VO3又会有氨气产生,故该工艺流程中可以循环利用的物质为:氨水或NH3和H2O;
(8)根据元素化合价升降相同,滴定过程有5(NH4)2Fe(SO4)2KMnO4,则过量的 (NH4)2Fe(SO4)2物质的量为5n(KMnO4)=5×b2C2103mol,则与(VO2)2SO4溶液反应的 (NH4)2Fe(SO4)2物质的量为(b1c15b2C2)×103mol,根据钒元素守恒,则有V2O52VO2+2(NH4)2Fe(SO4)2,故n(V2O5)=![]() (b1c15b2C2)×103mol,则产品中V2O5的质最分数是
(b1c15b2C2)×103mol,则产品中V2O5的质最分数是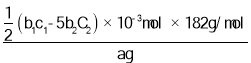 =
=![]()
![]() 100%。
100%。


科目:高中化学 来源: 题型:
【题目】开发新型储氢材料是开发利用氢能的重要研究方向。
(1)![]() 是一种储氢材料,可由
是一种储氢材料,可由![]() 和
和![]() 反应制得。
反应制得。
①基态Cl原子中,电子占据的最高电子层符号为 _______,该电子层具有的原子轨道数为 _______。
②Li、B、H元素的电负性由大到小的排列顺序为 ___________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+ ___________(填“>”“=”或“<”)H-。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如表所示:
|
|
|
|
|
738 | 1451 | 7733 | 10540 | 13630 |
则M是 ______________ (填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体。工艺原理如下图所示。下列说法中不正确的是( )
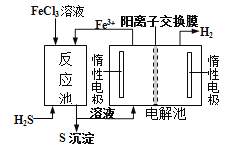
A. H+从电解池左槽迁移到右槽 B. 左槽中发生的反应是:2Cl--2e-=Cl2↑
C. 右槽的反应式: 2H++2e-=H2↑ D. FeCl3溶液可以循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机化合物中,不论两者以什么比例混合,只要总物质的量一定,则完全燃烧时生成的水的质量和消耗氧气的质量不变的是
A. CH4O,C3H4O5B. C3H6,C3H8O
C. C3H8,C4H6D. C2H6,C4H6O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构为: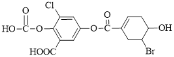 ,下列说法中正确的是
,下列说法中正确的是
A.该物质的化学式为C15H8O8BrCl
B.该物质能与FeCl3 溶液发生显色反应
C.1 mol 该物质最多能与 2 mol 溴水发生反应
D.一定条件下,1 mol 该物质最多能与 9 mol NaOH 反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下表中有关推论正确的是( )
已知事实 | 推论 | |
A | 氯乙烷能发生消去反应 | 所有的卤代烃都能发生消去反应 |
B | 乙烯分子内所有原子在同一平面上 | 丙烯分子内所有原子在同一平面上 |
C | 乙烯在空气中燃烧有黑烟 | 苯在空气中燃烧产生的烟更浓 |
D | 烷烃的含碳量随碳原子数的增大而增大 | 炔烃的含碳量随碳原子数的增大而增大 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中同分异构体数目最多的是( )
A.分子式为C4H10的二氯代物
B.分子式为C3H9N的有机物,其中N原子以三个单键与其他原子相连
C.分子式为C8H10的苯的同系物的一氯代物
D.分子式为C7H16的有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,图示装置和原理 能达到实验目的的是
A.灼烧海带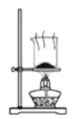
B.将海带灰溶解后分离出不溶性杂质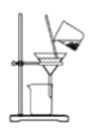
C.制备Cl2,并将I-氧化为I2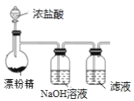
D.以淀粉为指示剂,用Na2SO3标准溶液滴定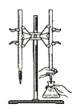
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种综合处理SO2废气的工艺流程。下列说法正确的是( )

A.向B溶液中滴加KSCN溶液,溶液可能变为红色
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2=2Fe3++2H2O
C.溶液酸性:A>B
D.加氧化亚铁可以使溶液C转化为溶液A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com