
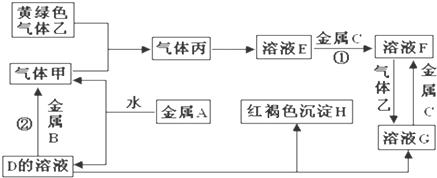
分析 金属A焰色反应为黄色,故A为金属Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;NaOH与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与H2反应生成丙为HCl,HCl溶于水得物质E为盐酸;NaOH与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl生成F、F生成G知,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,据此分析解答.
解答 解:金属A焰色反应为黄色,故A为金属Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;NaOH与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与H2反应生成丙为HCl,HCl溶于水得物质E为盐酸;NaOH与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl生成F、F生成G知,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,
(1)通过以上分析知,A、H、G、乙分别为Na、Fe(OH)3、FeCl3、Cl2,
故答案为:Na;Fe(OH)3;FeCl3;Cl2;
(2)反应①是Fe与盐酸反应生成氯化亚铁与氢气,反应方程式为:Fe+2HCl═FeCl2+H2↑;
反应②是Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:Fe+2HCl═FeCl2+H2↑;2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)氯化亚铁和氯气反应生成氯化铁,该反应离子方程式为2Fe 2++Cl2=2Fe 3++2Cl-,
故答案为:2Fe 2++Cl2=2Fe 3++2Cl-.
点评 本题以钠、铝和铁为载体考查无机物推断,为高频考点,明确物质性质及物质之间转化是解本题关键,以物质特殊颜色为突破口进行推断,需要学生熟练掌握元素化合物知识,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al14和稀盐酸反应的化学方程式可表示为Al14+2HCl→Al14Cl2+H2↑ | |
| B. | Al13超原子中Al原子间是通过共价键结合的 | |
| C. | Al14、Al13性质与Al相似,都具有较强的还原性 | |
| D. | Al13和Al14互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
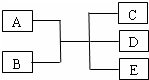 已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系.
已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol•L-1NaCl溶液 | B. | 75mL 1mol•L-1 CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物都属于电解质 | |
| B. | HCl全部发生氧化反应 | |
| C. | 该反应表明氧化性KClO3比Cl2强 | |
| D. | 1 mol KClO3在反应中得到6 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在测定中和反应的反应热实验中,只要读一次温度 | |
| B. | 可用pH试纸测定新制氯水的pH | |
| C. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| D. | 向CH3COONa溶液中滴入石蕊试液,溶液变蓝 | |
| E. | 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com