
| A. | 在测定中和反应的反应热实验中,只要读一次温度 | |
| B. | 可用pH试纸测定新制氯水的pH | |
| C. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| D. | 向CH3COONa溶液中滴入石蕊试液,溶液变蓝 | |
| E. | 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
分析 A.测定中和热实验中,需要测定酸溶液、碱溶液的温度及反应过程中的最高温度,每完成一次测量至少读三次温度;
B.新制的氯水中含有次氯酸,能够漂白pH试纸,无法测定出氯水的pH;
C.中和滴定过程中,锥形瓶中有少量的蒸馏水,不影响待测液中溶质的物质的量;
D.醋酸钠溶液为强碱弱酸盐,溶液显示碱性,所以石蕊试液变蓝;
E.白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,发生沉淀的转化.
解答 解:A.在测定中和反应的反应热实验中,每完成一次中和热测定,至少需要读三次温度:反应前酸溶液、碱溶液的体积和反应中最高温度,故A错误;
B.新制的氯水中存在次氯酸,次氯酸具有强氧化性,能够漂白有色物质,所以无法用pH试纸测定新制氯水的pH,应选pH计测定,故B错误;
C.中和滴定实验中,锥形瓶中有少量的蒸馏水,不影响待测液中溶质的物质的量,对测定结果没有影响,所以洗净后的锥形瓶不需要干燥,故C正确;
D.醋酸钠溶液中醋酸根离子水解,溶液为碱性溶液,所以向CH3COONa溶液中滴入石蕊试液,溶液变蓝,故D正确;
E.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,发生沉淀的转化,说明硫化铜更难溶,可知二者溶度积关系为:Ksp(ZnS)>Ksp(CuS),故E错误;
故选CD.
点评 本题考查化学实验方案的评价,为高频考点,涉及中和滴定、中和热的测定、难溶物的溶解平衡及沉淀转化、盐的水解原理等知识,把握物质的性质、反应原理及实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
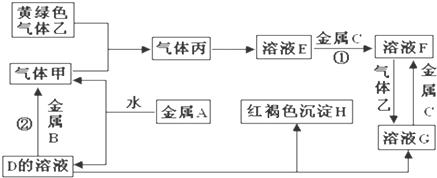
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  石油的分馏 | B. |  分离硝基苯和水 | ||
| C. |  除去甲烷中的乙烯 | D. | 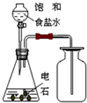 制取并收集乙炔气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 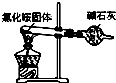 如图是氨气发生装置 | B. | 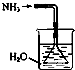 如图是氨气吸收装置 | ||
| C. | 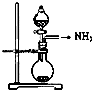 如图是氨气发生装置 | D. |  如图是氨气收集、检验装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡在溶液中反应Ba2++SO42-═BaSO4↓ | |
| B. | 氢氧化镁溶于稀硫酸:2H++Mg(OH)2═Mg2++2H2O | |
| C. | 大理石与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 少量金属钠投入到CuSO4溶液中 2Na+Cu2+═2Na++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
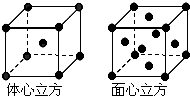 如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题 | ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同分异构体: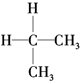 、 、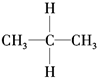 | B. | 烷烃:CH4、 、CH2═CH2 、CH2═CH2 | ||
| C. | 糖类:葡萄糖、蔗糖、纤维素 | D. | 有机高分子:塑料、橡胶、油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | |
| C | D |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com