
【题目】荧光材料硫化锌(ZnS)的研究至今已有 150 多年的历史,可用于制白色颜料、发光粉、发光油漆等,其久置于湿空气中易被氧化为 ZnSO4。请回答下列问题:
(1)基态 Zn 原子的电子排布式为_________________________,核外电子占据最高能层的符号是__________________________, 占据该能层电子的电子云轮廓图形状为__________________________。
(2)ZnSO4 中三种元素的电负性由大到小的顺序为__________________________,![]() 的立体构型为__________________________,其中 S 的杂化轨道类型为__________________________。
的立体构型为__________________________,其中 S 的杂化轨道类型为__________________________。
(3)ZnSO4 溶于氨水可生成[Zn(NH3)4]SO4 溶液,[Zn(NH3)4]SO4 溶液中不存在的微粒间作用力有__________________________。
A.离子键B.共价键C.配位键D.范德华力
(4)根据下列锌卤化物的熔点和溶解性,判断 ZnF2 晶体的类型为______;分析 ZnCl2、ZnBr2、ZnI2 熔点依次增大的原因__________________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中的溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
(5) 立方 ZnS 晶体的密度为 ρ g/cm3,其晶胞结构如图。

S2-周围等距离且最近的 Zn2+为__________________________;ZnS晶胞中的晶胞参数 a=__________________________nm(列出计算式)。[ M(ZnS)=97 g/mol ]
【答案】1s22s22p63s23p63d104s2或[Ar]3d104s2 N 球形 O>S>Zn 正四面体 sp3杂化 A
离子晶体 ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔点依次增大 4 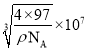
【解析】
根据原子核外电子排布规律书写Zn原子的核外电子排布式,根据元素周期律判断电负性大小,根据杂化轨道与价电子互斥理论判断粒子空间构型及杂化轨道类型,根据物理性质判断晶体类型,结合粒子间的作用力对熔沸点的影响进行分析,根据均摊法和立体几何知识进行晶胞的相关计算。
(1)Zn的核电荷数为30,基态Zn原子的电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,其核外电子占据最高能层的符号是N,占据该能层电子的为4s轨道,其电子云轮廓图形状为球形,故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;N;球形;
(2)ZnSO4中三种元素为Zn、O、S,非金属性的强弱顺序为O>S,Zn为金属元素,则电负性由大到小的顺序为O>S>Zn,硫酸根中中心原子的孤电子对数为![]() =0,成键电子对数为4,价层电子对数为4,所以立体构型为正四面体结构,中心原子S为sp3杂化,故答案为:O>S>Zn;正四面体;sp3杂化;
=0,成键电子对数为4,价层电子对数为4,所以立体构型为正四面体结构,中心原子S为sp3杂化,故答案为:O>S>Zn;正四面体;sp3杂化;
(3)[Zn(NH3)4]SO4中存在离子键、共价键、配位键,不存在范德华力,而[Zn(NH3)4]SO4在溶液中以离子形式存在,离子键不存在,溶剂H2O中存在共价键、水分子间存在范德华力,故答案为:A;
(4)根据表格信息可知,ZnF2晶体的熔点比ZnCl2、ZnBr2、ZnI2高,且不溶于乙醇、乙醚等有机溶剂,可判断晶体类型为离子晶体;ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔点依次增大,故答案为:离子晶体;ZnCl2、ZnBr2、ZnI2都是分子晶体,组成与结构相似,随着相对分子质量的增大,范德华力增强,熔点依次增大;
(5)由晶胞结构图可知,在ZnS晶胞结构中S2-周围等距离且最近的Zn2+为4,Zn2+位于晶胞的顶点和面心,S2-位于晶胞体内,则一个晶胞中Zn2+的个数为![]() ,S2-的个数为4,所以一个晶胞中含有4个ZnS,其物质的量为
,S2-的个数为4,所以一个晶胞中含有4个ZnS,其物质的量为![]() ,质量
,质量![]() ,该晶胞的密度为ρ g/cm3,则晶胞的体积
,该晶胞的密度为ρ g/cm3,则晶胞的体积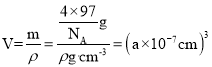 ,因此晶胞参数
,因此晶胞参数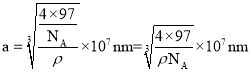 ,故答案为:4;
,故答案为:4;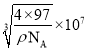 。
。


科目:高中化学 来源: 题型:
【题目】实验室有如下仪器:烧杯、漏斗、锥形瓶、分液漏斗、石棉网、酒精灯、玻璃棒、蒸发皿、蒸馏烧瓶、球形冷凝管、牛角管。只用上述仪器(夹持仪器省略)不能完成的实验为( )
A.从![]() 溶液中得到
溶液中得到![]() 晶体B.萃取碘水中的碘单质
晶体B.萃取碘水中的碘单质
C.分离溴苯(沸点156℃)和苯(沸点80℃)D.分离除过油污的铁屑与![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Fe(SO4)2·6H2O俗称摩尔盐(M=392g·mol-1)是分析化学中重要的标准物质,某研究小组拟采用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)为原料制取摩尔盐,设计了如下流程:
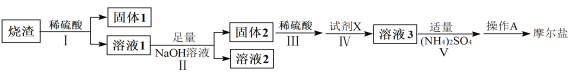
(1)写出试剂X的化学式__________。
(2)写出“溶液1”中某种离子与NaOH反应生成“溶液2”中离子的离子方程式________。
(3)操作A为蒸发浓缩至_________、冷却结晶、过滤、洗涤、干燥。其中过滤操作可用如图装置进行,请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→_________→d→c→关抽气泵。
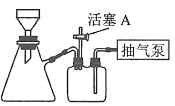
a.转移固液混合物
b.关活塞A
c.开活塞A
d.确认抽干
e.加洗涤剂洗涤
(4)实验制得的摩尔盐的纯度可用Ce(SO4)2标准溶液滴定进行测定。滴定反应为Fe2++Ce4+=Fe3++Ce3+。测定时,先称取4.000g样品,配成100mL溶液,取出其中20.00mL放入锥形瓶中,对溶液进行必要处理后,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表:
滴定次数 | 0.1000mol·L-1Ce(SO4)2标准溶液体积(mL) | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 20.12 |
2 | 0.12 | 20.10 |
3 | 0.05 | 21.65 |
①产品中摩尔盐的纯度为__________(用质量分数表示,保留4位有效数字)。
②若滴定过程中没有润洗滴定管,则会造成样品纯度______(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的或者实验操作不正确的是 ( )
A. 定容 B. 比较硫、碳、硅三种元素的非金属性
B. 比较硫、碳、硅三种元素的非金属性 C. 尾气处理
C. 尾气处理 D. 测定黄铜中锌的含量
D. 测定黄铜中锌的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关描述正确的是
A.0.1 mol/L 的(NH4) 2SO4 溶液:c(![]() )>c(
)>c(![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
B.0.1 mol/L 的 NaHCO3溶液:c(H+)+c(Na+)=c(OH-)+c(![]() )+2c(
)+2c(![]() )
)
C.常温下恰好中和等体积、相同 pH 的氨水和 NaOH 溶液,消耗盐酸的量相同
D.常温下醋酸钠和醋酸的混合溶液 pH=7,则 c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式:
① ![]() ;②
;② ![]() ;③
;③ ![]() ;④
;④ ![]() 。
。
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式如图所示:
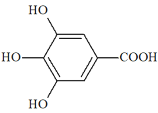
(1)1mol没食子酸与足量NaHCO3溶液反应,标准状况下可得________LCO2。
(2)没食子酸正丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为______________.
(3)尼泊金酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品添加剂。尼泊金丁酯的分子式为__________,其苯环只与—OH和—COOR两类取代基直接相连且两个取代基位于苯环对位的同分异构体有______种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铈铵、磷酸锰铵是两种重要的复盐,在工农业生产中具有广泛应用。
(1)复盐是由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐。下列物质属于复盐的是________(填序号)。
A.BaFe2O4 B.NaHSO4 C.KAl(SO4)2·12H2O D.Ag (NH3)2OH
(2)硝酸铈铵[(NH4)2Ce(NO3)6]的制备方法如下:
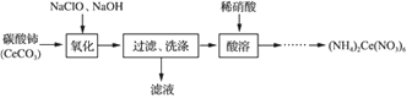
①“氧化”得到CeO2的化学方程式为______________。
②洗涤CeO2的方法是_____________。
(3)为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:
①称取样品2.4480g,加水溶解后配成100.00mL溶液A;
②量取25.00mL溶液A,加足量NaOH溶液并充分加热,生成NH30.06720L(标准状况);
③另取25.00mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH6~8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O40.2290g。通过计算确定该样品的化学式(写出计算过程) __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO![]() +2H2O
+2H2O
B.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO![]() =2Mn2++5SO
=2Mn2++5SO![]() +4H+
+4H+
C.Na2S2O3溶液与稀H2SO4反应的离子方程式:S2O![]() +6H+=2S↓+3H2O
+6H+=2S↓+3H2O
D.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe=2Fe3++3Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com