
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )。
A.标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA
B.常温下,0.1 mol·L-1NH4NO3溶液中NO3-数目为0.1NA
C.常温常压下,4.0 g CH4中含有共价键的数目为NA
D.标准状况下,22.4 L CHCl3含有分子的数目为NA
科目:高中化学 来源: 题型:
【题目】科研人员设想利用如图所示的装置生产硫酸,下列有关说法正确的是( )
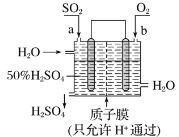
A.a 为正极,b 为负极
B.生产过程中氢离子由右移向左
C.从左下口流出的硫酸的质量分数一定大于 50%
D.负极反应式为 SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. HF、HCl、HBr、HI的熔沸点依次升高
B. CH4、CCl4都是含有极性键的非极性分子
C. CS2、H2S、C2H2都是直线形分子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2催化加氢制甲醇,是极具前景的温室气体资源化研究领域。在某CO催化加氢制甲醇的反应体系中,发生的主要反应有:
i.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
ⅱ.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
ⅲ.CO(g)+2H2(g) ![]() CH3OH(g) △H3
CH3OH(g) △H3
(1)△H3________ kJ·mol-1
(2)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
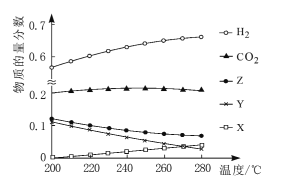
①体系中CO2的物质的量分数受温度的影响不大,原因是____。
②250℃时,反应ii的平衡常数____1(填“>”“<”或“=”)。
③下列措施中,无法提高甲醇产率的是____(填标号)。
A 加入适量CO B 增大压强 C 循环利用原料气 D 升高温度
④如图中X、Y分别代表____(填化学式)。
(3)反应i可能的反应历程如下图所示。
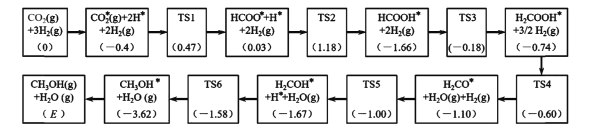
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV)。其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的决速步骤的反应方程式为____。
②相对总能量E=____(计算结果保留2位小数)。(已知:leV=1.6×10-22kJ)
(4)用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,往电解池的____极通入氢气,阴极上的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示,关于该物质的叙述错误的是( )
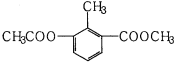
A.一个分子中含有12个H原子
B.苯环上的一氯代物有2种
C.能使酸性KMnO4溶液褪色
D.1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫草宁(shikonin,见下图)是从生长在亚洲学名叫Lithospermum erythrorhizon的一种植物的根部提取出来的红色化合物。几个世纪以来用做民间药物,如今用于配制治疗跌打损伤的膏药。下列说法不正确的是( )
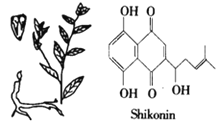
A. 紫草宁的分子式为C16H16O5
B. 等量的紫草宁与NaOH溶液、浓溴水反应,消耗NaOH、Br2 的物质的量之比为3:4
C. 紫草宁既能发生氧化反应又能发生还原反应
D. 常温下紫草宁不易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论在办公室还是居室里,在漂亮的花瓶中插上一束美丽的鲜花,将会给紧张而又忙碌的工作、生活带来轻松和愉悦的心情。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)_________(只要求写表达式,不需计算)mol·L-1。
(3)配制过程中,下列操作配制结果没有影响的是________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中含有______。(填化学符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将A和B各0.32mol充入恒容密闭容器中,发生反应:A(g)+B(g)![]() 2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.若起始时向容器中充入0.64molC,则达平衡时吸收的热量为0.12akJ
B.恒温,如果压缩容器体积,B的浓度和体积分数均不变
C.若起始时向容器中充入0.64molA和0.64molB,则达平衡时n(C)<0.40mol
D.恒温、恒容,向平衡体系中再充入0.32molA,再次平衡时,B的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用含AgCl的废渣制取AgNO3的工艺流程如下:
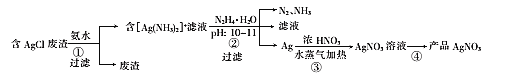
(1)步骤①用氨水浸取时,温度不宜超过35℃,其原因是 ___。在氨水浓度、固液质量比和温度均一定时,为提高银的浸取率还可采取的措施是____;浸取时发生反应的离子方程式为____。
(2)步骤②中发生反应的离子方程式为______。
(3)步骤③中,银与浓硝酸反应生成等物质的量的NO和NO2,当消耗了10.8g Ag时,有______molHNO3参与了反应。
(4)步骤④的操作为______,100℃下烘干得产品AgNO3。
(5)上述流程中发生了氧化还原反应的步骤有______(用“①”“②”“③”“④”填空)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com