
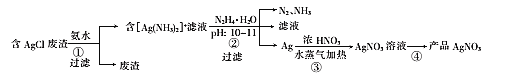
ЁОЬтФПЁПвЛжжРћгУКЌAgClЕФЗЯдќжЦШЁAgNO3ЕФЙЄвеСїГЬШчЯТЃК
(1)ВНжшЂйгУАБЫЎНўШЁЪБЃЌЮТЖШВЛвЫГЌЙ§35ЁцЃЌЦфдвђЪЧ ___ЁЃдкАБЫЎХЈЖШЁЂЙЬвКжЪСПБШКЭЮТЖШОљвЛЖЈЪБЃЌЮЊЬсИпвјЕФНўШЁТЪЛЙПЩВЩШЁЕФДыЪЉЪЧ____ЃЛНўШЁЪБЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ____ЁЃ
(2)ВНжшЂкжаЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ______ЁЃ
(3)ВНжшЂлжаЃЌвјгыХЈЯѕЫсЗДгІЩњГЩЕШЮяжЪЕФСПЕФNOКЭNO2ЃЌЕБЯћКФСЫ10.8g AgЪБЃЌга______molHNO3ВЮгыСЫЗДгІЁЃ
(4)ВНжшЂмЕФВйзїЮЊ______ЃЌ100ЁцЯТКцИЩЕУВњЦЗAgNO3ЁЃ
(5)ЩЯЪіСїГЬжаЗЂЩњСЫбѕЛЏЛЙдЗДгІЕФВНжшга______(гУЁАЂйЁБЁАЂкЁБЁАЂлЁБЁАЂмЁБЬюПе)ЁЃ
ЁОД№АИЁПЮТЖШЙ§ИпЛсМгЫйАБЕФЛгЗЂ ЪЪЕБбгГЄНўШЁЪБМфЛђепНЋТЫдќдйДЮНўШЁ AgCl+2NH3ЁЄH2O=[Ag(NH3)2]++Cl-+2H2O 4[Ag(NH3)2]++ N2H4ЁЄH2O=4AgЁ§+N2Ёќ+4NH4++4NH3Ёќ+H2O 0.15 еєЗЂХЈЫѕЁЂРфШДНсОЇЁЂЙ§ТЫ(ЯДЕг) ЂкЂл
ЁОНтЮіЁП
ЯђТШЛЏвјЗЯдќжаМгШыАБЫЎНўШЁЃЌЕУЕНКЌга[Ag(NH3)2]+ЕФТЫвКЃЌЪЪЕБЩ§ИпЮТЖШПЩвдМгПьЗДгІЫйТЪЃЌЮТЖШЙ§ИпгжЛсМгЫйАБЕФЛгЗЂЃЛЯђКЌга[Ag(NH3)2]+ЕФШмвКжаМгШыN2H4ЁЄH2OВЂЕїНкpHжС10ЁЋ11ЃЌИУЙ§ГЬжаAg+БЛЛЙдГЩAgЃЌВЂЩњГЩN2КЭNH3ЃЛНЋЙ§ТЫЕУЕНЕФвјЕЅжЪШмгкХЈЯѕЫсЃЌЕУЕНЯѕЫсвјШмвКЃЌжЎКѓОЙ§еєЗЂХЈЫѕЁЂРфШДНсОЇЁЂЙ§ТЫЯДЕгЕУЕНAgNO3ЁЃ
ЃЈ1ЃЉАБЦјвзЛгЗЂЃЌЮТЖШЙ§ИпЛсМгЫйАБЕФЛгЗЂЃЌдьГЩдСЯЕФРЫЗбЃЛдкАБЫЎХЈЖШЁЂЙЬвКжЪСПБШКЭЮТЖШОљвЛЖЈЪБЃЌЮЊЬсИпвјЕФНўШЁТЪЛЙПЩЪЪЕБбгГЄНўШЁЪБМфЛђепНЋТЫдќдйДЮНўШЁЃЛИљОнСїГЬПЩжЊЗДгІЮяЮЊAgClКЭАБЫЎЃЌЫљвдРызгЗНГЬЪНЮЊЃКAgCl+2NH3ЁЄH2O=[Ag(NH3)2]++Cl-+2H2OЃЛ
ЃЈ2ЃЉЗДгІЂкжаAg+БЛЛЙдГЩAgЃЌN2H4ЁЄH2OБЛбѕЛЏЮЊN2ЃЌЭЌЪБгаАБЦјЩњГЩЃЌИљОнЕчзгЪиКуКЭдЊЫиЪиКуПЩЕУЗНГЬЪНЮЊЃК4[Ag(NH3)2]++ N2H4ЁЄH2O=4AgЁ§+N2Ёќ+4NH4++4NH3Ёќ+H2OЃЛ
ЃЈ3ЃЉ10.8g AgЕФЮяжЪЕФСПЮЊ0.1molЃЌдђЩњГЩЕФnЃЈAgNO3ЃЉ=0.1molЃЌЩшЩњГЩЕФnЃЈNOЃЉ= nЃЈNO2ЃЉ=xЃЌИљОнЕчзгЪиКуПЩжЊx+3x=0.1molЃЌЫљвдx=0.025molЃЌдђИљОнЕЊдЊЫиЪиКуПЩжЊЯћКФЕФЯѕЫсЕФЮяжЪЕФСПЮЊ0.1mol+0.025mol+0.025mol=0.15molЃЛ
ЃЈ4ЃЉДгШмвКжаЛёШЁОЇЬхвЛАуашвЊОЙ§ЃКеєЗЂХЈЫѕЁЂРфШДНсОЇЁЂЙ§ТЫЁЂЯДЕгЁЂИЩдяЕШВйзїЃЛ
ЃЈ5ЃЉВНжшЂйЕФЗДгІУЛгаЛЏКЯМлБфЛЏВЛЪєгкбѕЛЏЛЙдЃЛВНжшЂкжаAgдЊЫиЛЏКЯМлНЕЕЭЃЌNдЊЫиЛЏКЯМлЩ§ИпЃЌЪєгкбѕЛЏЛЙдЗДгІЃЛВНжшЂлжаЯѕЫсНЋвјЕЅжЪбѕЛЏЪєгкбѕЛЏЛЙдЗДгІЃЛВНжшЂмЮЊеєЗЂНсОЇЙ§ГЬЃЌУЛгадЊЫиЛЏКЯМлЗЂЩњБфЛЏЃЌВЛЪєгкбѕЛЏЛЙдЗДгІЃЌзлЩЯЫљЪіЪєгкбѕЛЏЛЙдЕФЮЊЂкЂлЁЃ


 УћаЃПЮЬУЯЕСаД№АИ
УћаЃПЮЬУЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃЯТСаа№Ъіе§ШЗЕФЪЧЃЈ ЃЉЁЃ
A.БъзМзДПіЯТЃЌ2.24 L Cl2ЭЈШызуСПNaOHШмвКжаЃЌЗДгІзЊвЦЕчзгЕФЪ§ФПЮЊ0.2NA
B.ГЃЮТЯТЃЌ0.1 molЁЄLЃ1NH4NO3ШмвКжаNO3ЃЪ§ФПЮЊ0.1NA
C.ГЃЮТГЃбЙЯТЃЌ4.0 g CH4жаКЌгаЙВМлМќЕФЪ§ФПЮЊNA
D.БъзМзДПіЯТЃЌ22.4 L CHCl3КЌгаЗжзгЕФЪ§ФПЮЊNA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖўМзУбЃЈCH3OCH3ЃЉБЛГЦЮЊ21ЪРМЭЕФаТаЭШМСЯЃЌ25ЁцЃЌ101kPaЪБГЪЦјЬЌЃЌЫќЧхНрЁЂИпаЇЁЂОпгагХСМЕФЛЗБЃадФмЁЃ92gЦјЬЌЖўМзУб25ЁцЃЌ101kPaЪБШМЩеЗХШШ2910kJЁЃ
(1)ЕБШМЩеЗХШШ582kJШШСПЪБЃЌзЊвЦЕФЕчзгЪ§ЮЊ___ЁЃ
(2)вбжЊH2(g)КЭC(s)ЕФШМЩеШШЗжБ№ЪЧ285.8kJ/molЁЂ393.5kJ/molЃЛМЦЫуЗДгІ4C(s)+6H2(g)+O2(g)ЈT2CH3OCH3(g)ЕФЗДгІШШЮЊ__ЃЛ
(3)ЙЄвЕЩЯРћгУH2КЭCO2КЯГЩЖўМзУбЕФЗДгІШчЯТЃК6H2(g)+2CO2(g)CH3OCH3(g)+3H2O(g) ЁїHЃМ0
ЂйвЛЖЈЮТЖШЯТЃЌдквЛИіЙЬЖЈЬхЛ§ЕФУмБеШнЦїжаНјааИУЗДгІЃЌЯТСаФмХаЖЯЗДгІДяЕНЛЏбЇЦНКтзДЬЌЕФЪЧ__ЃЈбЁЬюзжФИБрКХЃЉ
AЃЎc(H2)гыc(H2O)ЕФБШжЕБЃГжВЛБф
BЃЎЕЅЮЛЪБМфФкга2molH2ЯћКФЪБга1molH2OЩњГЩ
CЃЎШнЦїжаЦјЬхУмЖШВЛдйИФБф
DЃЎШнЦїжаЦјЬхбЙЧПВЛдйИФБф
EЃЎЗДгІВњЩњЕФШШСПВЛдйБфЛЏ
ЂкЮТЖШЩ§ИпЃЌИУЛЏбЇЦНКтвЦЖЏКѓЕНДяаТЕФЦНКтЃЌCH3OCH3ЕФВњСПНЋ__ЃЈЬюЁАБфДѓЁБЁЂЁАБфаЁЁБЛђЁАВЛБфЁБЃЌЯТЭЌЃЉЃЌЛьКЯЦјЬхЕФЦНОљФІЖћжЪСПНЋ__ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПфхБНЪЧвЛжжживЊЛЏЙЄдСЯЃЌЪЕбщЪвжЦБИфхБНЕФЗДгІзАжУШчЭМЫљЪОЃЌгаЙиЪ§ОнШчЯТЃК
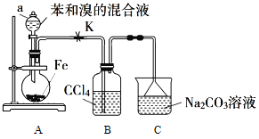
БН | фх | фхБН | |
ЯрЖдЗжзгжЪСП | 78 | 160 | 157 |
УмЖШ/gcm-3 | 0.88 | 3.10 | 1.50 |
ЗаЕу/Ёц | 80 | 59 | 156 |
ЫЎжаШмНтЖШ | ЮЂШм | ЮЂШм | ЮЂШм |
АДЯТСаКЯГЩВНжшЛиД№ЮЪЬтЃК
ЃЈ1ЃЉвЧЦїaЕФУћГЦЮЊ___ЁЃ
ЃЈ2ЃЉдкAзАжУжаМгШы7.8mLЮоЫЎБНЁЂЪЪСПвКЬЌфхКЭЩйСПЬњаМЁЃЪЕбщЪБзАжУBжаПЩФмЕФЯжЯѓЮЊ___ЃЌзАжУCЕФзїгУЪЧ___ЁЃ
ЃЈ3ЃЉЗДгІГфЗжКѓЃЌШЁAзАжУжаЗДгІвКЃЌОЙ§ЯТСаВНжшЗжРыЬсДПЃК
ЂйЯђЦфжаМгШыЪЪСП___ЃЈЬюЪдМСУћГЦЃЉЃЌШЛКѓ___ЃЈЬюВйзїУћГЦЃЉГ§ШЅЮДЗДгІЕФЬњаМЃЛ
ЂкТЫвКвРДЮгУЫЎЁЂl0%ЕФNaOHШмвКЁЂЫЎЯДЕгЁЃNaOHШмвКЯДЕгЕФзїгУЪЧ___ЃЛ
ЂлЯђЗжГіЕФДжфхБНжаМгШыЩйСПЕФЮоЫЎТШЛЏИЦЃЌОВжУЁЂЙ§ТЫЁЃ
ЃЈ4ЃЉОвдЩЯЗжРыВйзїКѓЃЌДжфхБНжаЛЙКЌгавЛЖЈСПЕФдгжЪЃЌвЊНјвЛВНЬсДПЃЌЯТСавЧЦїдкИУЬсДПВНжшжаУЛгаЪЙгУЕНЕФЪЧ___(ЬюШые§ШЗбЁЯюЧАЕФзжФИ)ЁЃ
A. B.
B.![]() C. D.
C. D.
ЃЈ5ЃЉзюжеЕУЕНВњЦЗ5.5mLЃЌБОЪЕбщЕФВњТЪЪЧ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇПЮЭтаЁзщгУЭМзАжУжЦШЁфхБНЁЃЯШЯђЗжвКТЉЖЗжаМгШыБНКЭвКфхЃЌдйНЋЛьКЯвКТ§Т§ЕЮШыЗДгІЦїA(AЯТЖЫЛюШћЙиБе)жаЁЃ

(1)аДГіAжаЗДгІЕФЛЏбЇЗНГЬЪН_______________ЁЃ
(2)ЙлВьЕНAжаЕФЯжЯѓЪЧ_____________________ЁЃ
(3)ЪЕбщНсЪјЪБЃЌДђПЊAЯТЖЫЕФЛюШћЃЌШУЗДгІвКСїШыBжаЃЌГфЗжеёЕДЃЌФПЕФЪЧ________ЃЌаДГігаЙиЕФЛЏбЇЗНГЬЪН______________________________ЁЃ
(4)CжаЪЂЗХCCl4ЕФзїгУЪЧ________________ЁЃ
(5)ФмжЄУїБНКЭвКфхЗЂЩњЕФЪЧШЁДњЗДгІЃЌЖјВЛЪЧМгГЩЗДгІЃЌПЩЯђЪдЙмDжаМгШыAgNO3ШмвКЃЌШєВњЩњЕЛЦЩЋГСЕэЃЌдђФмжЄУїЁЃСэвЛжжбщжЄЕФЗНЗЈЪЧЯђЪдЙмDжаМгШы_______ЃЌЯжЯѓЪЧ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖЬжмЦкжїзхдЊЫиWЁЂXЁЂYЁЂZЕФдзгађЪ§вРДЮдіДѓЃЌWЕФдзгађЪ§ЪЧZЕФдзгађЪ§ЕФвЛАыЃЌWЁЂXЁЂYШ§жждЊЫиаЮГЩЕФЛЏКЯЮяMНсЙЙШчЭМЫљЪОЁЃЯТСаа№Ъіе§ШЗЕФЪЧ
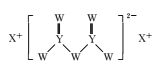
A.дзгАыОЖЃКZ>Y>W
B.ЛЏКЯЮяMжаWЕФдзгТњзу8ЕчзгЮШЖЈНсЙЙ
C.ЖдгІЕЅжЪЕФШлЕуЃКX>Z>Y
D.ZЕФбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЮЊЧПЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯгУЯДОЛЕФЗЯЭаМзїдСЯРДжЦБИЯѕЫсЭЁЃЮЊСЫЗРжЙЛЗОГЮлШОЃЌвЫВЩгУЕФЗНЗЈЪЧ
A.Cu+4HNO3(ХЈ)=Cu(NO3)2+2NO2Ёќ+2H2O
B.3Cu+8HNO3(ЯЁ)=3Cu(NO3)2+2NOЁќ+4H2O
C.2Cu+O2![]() 2CuOЃЛCuO+2HNO3=Cu(NO3)2+H2O
2CuOЃЛCuO+2HNO3=Cu(NO3)2+H2O
D.Cu+2H2OS4(ХЈ)![]() CuSO4+2SO2Ёќ+2H2OЃЛCuSO4+Ba(NO3)2=Cu(NO3)2+BaSO4Ё§
CuSO4+2SO2Ёќ+2H2OЃЛCuSO4+Ba(NO3)2=Cu(NO3)2+BaSO4Ё§
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊМзЮЊКуЮТЁЂКубЙШнЦїЃЌввЮЊКуЮТЁЂКуШнШнЦїЁЃСНШнЦїжаОљГфШы1 mol N2ЁЂ3 mol H2ЃЌГѕЪМЪБСНШнЦїЕФЮТЖШЁЂЬхЛ§ЯрЭЌЁЃвЛЖЮЪБМфКѓЗДгІДяЕНЦНКтЃЌЮЊЪЙСНШнЦїжаЕФN2дкЦНКтЛьКЯЮяжаЕФЮяжЪЕФСПЗжЪ§ЯрЭЌЃЌЯТСаДыЪЉжаПЩааЕФЪЧ ( )
A.ЯђМзШнЦїжаГфШывЛЖЈСПЕФКЄЦј
B.ЯђввШнЦїжаГфШывЛЖЈСПЕФN2
C.Щ§ИпввШнЦїЕФЮТЖШ
D.діДѓМзШнЦїЕФбЙЧП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЫФжжЧПЕчНтжЪШмвКЃЌЗжБ№КЌгаЯТСавѕЁЂбєРызгжаЕФИївЛжжЃЌВЂЧвЛЅВЛжиИДЃКNH4+ЁЂBa2ЃЋЁЂNaЃЋЁЂHЃЋЁЂSO42-ЁЂNO3-ЁЂOHЃЁЂCO32-ЁЃНЋетЫФжжШмвКЗжБ№БъМЧЮЊAЁЂBЁЂCЁЂDЃЌНјааШчЯТЪЕбщЃКЂйдкAЛђDжаЕЮШыCЃЌОљгаГСЕэЩњГЩЃЛЂкDКЭBЗДгІЩњГЩЕФЦјЬхФмБЛAЮќЪеЃЛЂлAКЭDЗДгІЩњГЩЕФЦјЬхФмБЛBЮќЪеЁЃЪдЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉDЕФЛЏбЇЪНЪЧ________ЃЌХаЖЯРэгЩЪЧ_________________________________ЁЃ
ЃЈ2ЃЉаДГіЯргІЮяжЪЕФЛЏбЇЪНЃКA___________ЃЌC___________ЁЃ
ЃЈ3ЃЉаДГіЪЕбщЂкжагаЙиЗДгІЕФРызгЗНГЬЪН___________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com