
【题目】下列说法正确的是( )
A.含有OH-的溶液一定呈碱性
B.pH为3的盐酸的c(H+)是pH为1的盐酸的100倍
C.Na2SO3溶液与NaHSO3溶液中所含微粒的种类一定相同
D.pH相同的氨水与氢氧化钠溶液,分别与同浓度同体积的盐酸完全中和时,消耗氨水与氢氧化钠溶液的体积一定相同
【答案】C
【解析】
A. 含有OH-的溶液也含有氢离子,两种离子浓度大小关系不能确定,故溶液不一定呈碱性,A错误;
B. pH为1的盐酸的c(H+)=10-1mol/L,pH为3的盐酸的c(H+)=10-3mol/L,所以前者氢离子浓度是后者氢离子浓度的100倍,B错误;
C. Na2 SO3溶液与NaHSO3溶液中所含微粒的种类一定相同,因为Na2SO3水解、NaHSO3既电离又水解,故它们均含有Na+、![]() 、
、![]() 、H2SO3、H2O、OH-、H+七种微粒,C正确;
、H2SO3、H2O、OH-、H+七种微粒,C正确;
D. pH相同的氨水与氢氧化钠溶液,因为一水合氨是弱电解质,故氨水的物质的量浓度比氢氧化钠大得多,当它们分别与同浓度同体积的盐酸完全中和时,消耗氨水的体积远小于氢氧化钠溶液的体积,D错误;
答案选C。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】丙炔酸甲酯(![]() )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
)是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为 ![]() +CH3OH
+CH3OH![]()
![]() +H2O
+H2O
实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
(1)步骤1中,加入过量甲醇的目的是________。
(2)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是_______;分离出有机相的操作名称为__________。
(3)步骤4中,蒸馏时不能用水浴加热的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应:CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由此计算:反应达平衡时,二甲醚的分解率为______,该温度下平衡常数Kc=______。(填数值)
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),在恒温恒容下,若要缩短上述反应达到平衡的时间,可采取的措施有______、______。
(2)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)CH3CHO(g)。反应速率v=v正v逆=k正p(CO)p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,当CO转化率为20%时,![]() =______。
=______。
(3)工业上常用高浓度的K2CO3溶液吸收CO2得到溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
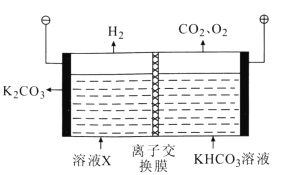
①在阳极区发生的反应包括(电极反应)______和H++![]() =CO2↑+H2O。
=CO2↑+H2O。
②用离子方程式表示![]() 在阴极区再生的过程:______。
在阴极区再生的过程:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
A.氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2![]() =Mg2++2NH3H2O
=Mg2++2NH3H2O
B.沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
C.用食醋能清洗水垢:![]() +2CH3COOH=2CH3COO+H2O+CO2↑
+2CH3COOH=2CH3COO+H2O+CO2↑
D.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H+ + OH-正向移动且溶液呈酸性的是( )
H+ + OH-正向移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使水的pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题:
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如图所示。A包含物质为H2O和________(填化学式)。
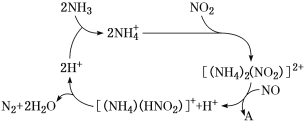
(2)已知:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH1=-a kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的ΔH=________ kJ·mol-1。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) ΔH>0。
HCN(g)+3H2(g) ΔH>0。
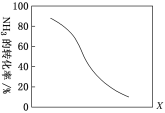
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是________(填字母)。
a.温度 b.压强 c.催化剂 d.![]()
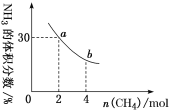
②在一定温度下,向2 L密闭容器中加入 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如下图所示。a点时,CH4的转化率为_______%;平衡常数:K(a)____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为Mb(aq)+O2(g) ![]() MbO2(aq),该反应的平衡常数可表示为K=
MbO2(aq),该反应的平衡常数可表示为K=![]() 。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=
。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=![]() ×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。
×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的一种制取Cu2O的电解池示意图如下,电池总反应为2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
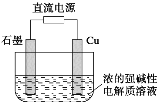
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的密闭容器中发生反应2X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.3 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,反应达到平衡时各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.3 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,反应达到平衡时各物质的浓度有可能是
A.X2为0.5 mol·L-1B.X2为0.15 mol·L-1
C.Y2为0.2 mol·L-1D.Z为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物阿司匹林可由水杨酸制得,它们的结构如图所示有关说法正确的是
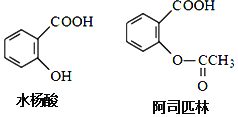
A.服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液
B.阿司匹林的分子式为C9H10O4
C.水杨酸可以发生取代、加成、氧化、加聚反应
D.1mol阿司匹林最多可消耗2molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com