
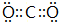 ,故答案为:
,故答案为: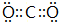 ;
;

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

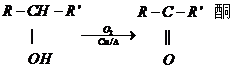 (酮中R、R′代表烃基且酮不能再被氧化为羧酸,其它物质中R、R′代表烃基或氢原子)
(酮中R、R′代表烃基且酮不能再被氧化为羧酸,其它物质中R、R′代表烃基或氢原子)
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向澄清石灰水中加入等物质的量的NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
| B、向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3?H2O+H2O |
| C、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
| D、氯化铝溶液中加入过量氨水Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
| ④ |
| ⑤ |
| H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石、C60都有较大的硬度和较高的熔点 |
| B、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C、Cl2、SO2都可以使品红溶液褪色 |
| D、镁、铁等金属在一定条件下与水反应都生成对应的氢氧化物和氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com