
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是( )
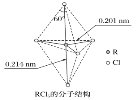
A. 每个原子都达到8电子稳定结构
B. 分子中5个R—Cl键键能不相同
C. 键角(Cl—R—Cl)有90°、120°、180°几种
D. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
【答案】C
【解析】
A.R原子最外层有5个电子,形成5个共用电子对;
B.根据键长越短,键能越大判断;
C.上下两个顶点与中心R原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°;
D.根据RCl5和RCl3的空间构型进行分析。
A.R原子最外层有5个电子,形成5个共用电子对,所以RCl5中R的最外层电子数为10,不满足8电子稳定结构,故A错误;
B.RCl5分子中5个R—Cl键,键长不都相同,键长不同,所以键能不完全相同,故B错误;
C.上下两个顶点与中心R原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°,所以键角(Cl-R-Cl)有90°、120、180°几种,故C正确;
D.由图可知RCl5分子空间构型是对称的,是非极性分子,而RCl3是三角锥形,是极性分子,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】课外小组的同学利用下图装置研究铜与稀硝酸的反应。
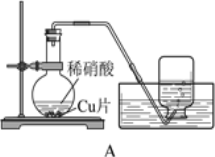
(1)铜与稀硝酸的反应中,硝酸体现了______(填“氧化性”或“还原性”)。
(2)铜与稀硝酸反应的化学方程式是______。
(3)集气瓶收集到无色气体,该气体的主要成分是______。
(4)某同学认为上述实验不足以证明反应生成的是该气体,他的理由是______(结合化学方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用酸性KMnO4溶液与草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入1滴3 mol/L硫酸和9滴蒸馏水,最后加入1 mL 0.1 mol/L草酸溶液 | 前10 min内溶液紫色无明显变化,后颜色逐渐变浅,30 min后几乎变为无色 |
II | 向另一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入10滴3 mol/L硫酸,最后加入1 mL 0.1 mol/L草酸溶液 | 80 s内溶液紫色无明显变化,后颜色迅速变浅,约150 s后几乎变为无色 |
(1)写出高锰酸钾与草酸反应的离子方程式:______________________________。
(2)由实验I、II可得出的结论是_______________________________。
(3)关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出猜想:反应中生成的Mn2+对该反应有催化作用。利用提供的试剂设计实验III,验证猜想。提供的试剂:0.01 mol/L酸性 KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水补全实验III的操作:向试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,_______,最后加入1 mL 0.1 mol/L草酸溶液。
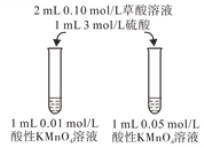
(4)该小组拟采用如图所示的实验方案继续探究KMnO4溶液浓度对反应速率的影响。你认为他们的实验方案______(填“合理”或“不合理”),理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:

(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,D含有的官能团名称为_____。
(2)写出⑥步反应的化学方程式,并注明反应类型:_____,反应类型_____。
(3)烃A也可以由乙炔和氢气加成得到,写出实验室制乙炔的化学方程式_____。
(4)除去B中混有的少量杂质A,所用的试剂为_____。
(5)图中由A制备C的最好途径是通过反应_____(填写“②”或“①⑤”),理由是:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CF3COOH水溶液中将甲烷直接转化为CF3COOCH3(水解生成CH3OH)的反应机理如图,下列说法正确的是
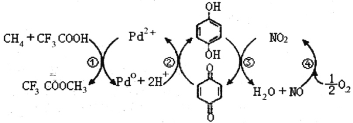
A.所含部分元素第一电离能:C<N<O<F
B.反应③的氧化剂为对苯二酚
C.上述反应的总反应式为:CH4+CF3COOH+![]() O2
O2 CF3COOCH3+H2O
CF3COOCH3+H2O
D.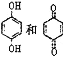 均可以与浓溴水反应,且反应类型相同
均可以与浓溴水反应,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是_____。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第一电离能I2/kJ·mol-1 | 1561 | 1958 |
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:

①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
(3)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为_______cm(列出计算式即可)。
),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为_______cm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
物质 | 沸点/℃ | 密度 / gcm-3 | 水中溶解性 |
|
正丁醇 | 117.2 | 0.8109 | 微溶 | |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐试样不含KIO3 |
B | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡: |
D | 室温下向CuCl2和少量FeCl3的混合溶液中,加入铜屑,充分搅拌,过滤,得蓝绿色溶液 | 除去杂质FeCl3得纯净CuCl2溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铁的腐蚀和防护的叙述正确的是( )
A.用铁锅烧制糖醋鱼时,铁锅会发生化学腐蚀和析氢腐蚀
B.铁发生吸氧腐蚀的负极反应可用O2+4e-+2H2O=4OH-表示
C.常温下,铁在浓硫酸中比在稀硫酸中腐蚀得快
D.可用如图表示对钢铁采取外加电流的阴极保护法的原理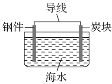
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com