
����Ŀ������˵����ȷ����
A.��ȥFeSO4 ��Һ�е� Fe3+�� ������Һ�м���ͭ�ۣ� ͨ����Ӧ Cu + 2Fe3+ = Cu2+ + 2Fe2+��ȥ Fe3+
B.�����£�pHΪ5�� NH4Cl ��Һ��pHΪ5��ϡ�����У�ˮ�ĵ���̶���ͬ
C.���ڴ���ˮ�ĵ��룬0.1 molL-1 �� H2C2O4��Һ�У� c(H+)/c(C2O![]() )�Դ���2
)�Դ���2
D.��ˮ�еμӵ�Ũ�ȵ�������Һ���μӹ����У�c(NH![]() )��������С
)��������С
���𰸡�D
��������
A������Һ�м���ͭ�ۣ�ͭ�� Fe3+������Ӧ Cu + 2Fe3+ = Cu2+ + 2Fe2+��������Cu2+ ���ʣ������ϳ���ԭ��A����
B��NH4Cl ˮ��ٽ�ˮ�ĵ��룬ϡ��������������������������ˮ�ĵ��룬��˳����£�pHΪ5�� NH4Cl ��Һ��pHΪ5��ϡ�����У�ˮ�ĵ���̶Ȳ���ͬ����B����
C������Ϊ���ᣬ�Ե�һ������Ϊ�������0.1 molL-1 �� H2C2O4��Һ��c(H+)/c(C2O![]() )Զ����2����C����
)Զ����2����C����
D����ˮ�д���NH3��H2O![]() NH4+��OH�����μӵ�Ũ�ȵ�������Һ��c(OH-)��С��ƽ�������ƶ���c(NH
NH4+��OH�����μӵ�Ũ�ȵ�������Һ��c(OH-)��С��ƽ�������ƶ���c(NH![]() )��������ǡ����ȫ��Ӧ������μӵ�Ũ�ȵ�������Һ����Һ���������c(NH
)��������ǡ����ȫ��Ӧ������μӵ�Ũ�ȵ�������Һ����Һ���������c(NH![]() )�ּ�С����D��ȷ��
)�ּ�С����D��ȷ��
��ѡD��


 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ�ĵ���
A | B | C | D | |
ʵ�鷽�� |
���ڹ����� |
|
|
|
ʵ��Ŀ�� | ��֤����������������ѧ��Ӧ | �к��ȵIJⶨ | ��֤��Ȳ�Ļ�ԭ�� | ��֤�����������ⸯʴ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
A.��![]() ��Һ�м�������
��Һ�м�������![]() ��Һ��
��Һ��![]()
B.���ʵ���Ũ�ȶ�Ϊ![]() ��
��![]() ��
��![]() ��Һ�������Ϻ�
��Һ�������Ϻ�![]()
C.��֪�����£�![]() �ĵ��볣��
�ĵ��볣��![]() ��
��![]() .
.![]() ��Һ��
��Һ��![]()
D.![]() ��Һ��
��Һ��![]() ��Һ��ϣ�
��Һ��ϣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���������������̬����ɣ�ȡ�����![]() �û��������ȫȼ�պ�õ�
�û��������ȫȼ�պ�õ�![]() ������̼
������̼![]() ����������Ϊ��״��
����������Ϊ��״��![]() ��10.8gˮ�������������������
��10.8gˮ�������������������
A.![]() ��
��![]() B.
B.![]() ��
��![]() C.
C.![]() ��
��![]() D.
D.![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�������仯������ͼ��ʾ��ϵ����

A.CaCO3![]() CaO + CO2��
CaO + CO2��
B.2CH3CH2OH + O2![]() 2CH3CHO+ 2H2O
2CH3CHO+ 2H2O
C.2NH4Cl+ Ba(OH)2 = BaCl2+ 2NH3 H2O
D.2Na+2H2O =2NaOH + H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Խ����У�H2O2��ʹ KMnO4��Һ��ɫ�����ӷ�Ӧ(δ��ƽ)Ϊ��MnO![]() + H+ + H2O2��Mn2++ O2 + H2O������˵���������
+ H+ + H2O2��Mn2++ O2 + H2O������˵���������
A.�����ԱȽϣ�MnO![]() > O2
> O2
B.�÷�Ӧ�����Խ��ʿ���Ϊ����
C.�������뻹ԭ�������ʵ���֮��Ϊ2��5
D.����0.1 mol�����������ɣ� ��ת�Ƶ���0.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���к͵ζ���ʵ���Ҷ����ⶨδ֪����Ũ�ȵ���Ҫ������25��ʱ���� 20.00 mL NaOH��Һ����ε���ijŨ�ȵ�CH3COOH��Һ�Բⶨ�ô�����Һ��Ũ�ȡ��ζ������У���Һ��pH�����CH3COOH ��Һ�������ϵ��ͼ��ʾ�� �ش��������⣺
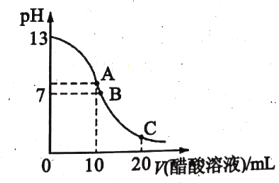
��1���ζ�ʱ��ʹ�õ�����Ҫ����������__________��
��2��ѡ���ָʾ����_________������жϵζ��ﵽ�յ� _____________��
��3�������ζ��ﵽ�յ�ʱ��������� CH3COOH ��Һ�����Ϊ 10.00 mL. �����������Һ��Ũ��Ϊ _________molL-1��
��4��ͼ��B ����ʾ��Һ��c(Na +)______c(CH3COO-)����������������������������
��5��ͼ�� C ���Ӧ��pH=4.7���õ���ʾ��Һ��c(CH3COO-)+ c(OH-)-c(Na+)=________ molL-1����֪��lg2=0.3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ�ﰢ˾ƥ�ֿ���ˮ�����Ƶã����ǵĽṹ��ͼ��ʾ�й�˵����ȷ����
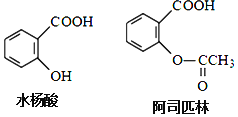
A.���ð�˾ƥ�֣��������ˮ�������Ӧʱ���ɾ���ע��NaHCO3��Һ
B.��˾ƥ�ֵķ���ʽΪC9H10O4
C.ˮ������Է���ȡ�����ӳɡ��������Ӿ۷�Ӧ
D.1mol��˾ƥ����������2molNaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() (a).
(a). ![]() (b).
(b). ![]() (c)�ķ�ʽ��ΪC5H6�������й�������ȷ����
(c)�ķ�ʽ��ΪC5H6�������й�������ȷ����
A. ���Ϸ���ʽΪC5H6��ͬ���칹��ֻ��a��b��c����
B. a��b��c��һ�ȴ��ﶼֻ������
C. a��b��c����ʹ���CCl4��Һ��ɫ������ɫԭ����ͬ
D. a��b��c�����е�5��̼ԭ��һ��������ͬһ��ƽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com