
【题目】氨甲环酸(G),别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略)。
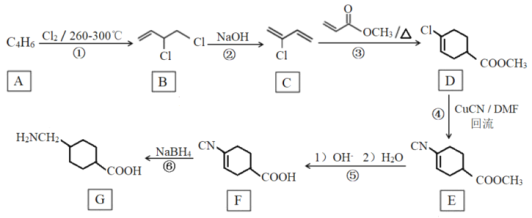
(1)A的名称是_________________。
(2)②的化学方程式是___________。
(3)③的反应类型是_____________。
(4)D中的官能团名称是_________。
(5)下列说法正确的是_____________(填字母序号)。
a.反应⑥是还原反应
b.F与![]() 互为同分异构体
互为同分异构体
c.G在碱性条件下可以转变成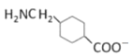
d.G在酸性条件下可以转变成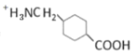
(6)写出满足以下条件的所有E的同分异构体的结构简式______________________。
a. 与硝基苯互为同系物 b.苯环上只有两个取代基 c.苯环上一氯代物有2种
(7)以CH3CH=CH2、HCHO为有机原料,选用必要的无机试剂合成上述流程中的A:CH3-CH=CH2![]() Br-CH2-CH=CH2→___________。已知:RX
Br-CH2-CH=CH2→___________。已知:RX![]() R—MgX
R—MgX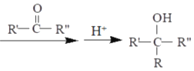 (R、R'、R〃代表烃基或氢)
(R、R'、R〃代表烃基或氢)
【答案】1,3-丁二烯 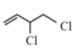 +NaOH
+NaOH![]()
![]() +NaCl+H2O 加成反应 碳碳双键,氯原子,酯基 abcd
+NaCl+H2O 加成反应 碳碳双键,氯原子,酯基 abcd 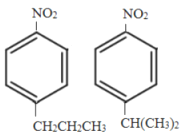
![]()
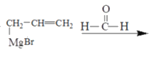
![]()
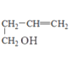
![]() CH2=CH-CH=CH2
CH2=CH-CH=CH2
【解析】
由B的结构可逆推A为CH2=CH-CH=CH2,A与Cl2加成生成![]() (B);B在NaOH醇溶液中消去生成
(B);B在NaOH醇溶液中消去生成![]() (C);C与
(C);C与![]() 在加热条件下加成生成
在加热条件下加成生成 (D);D与CuCN在DMF作用下发生取代生成
(D);D与CuCN在DMF作用下发生取代生成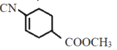 (E);E在碱性条件下水解生成
(E);E在碱性条件下水解生成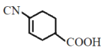 (F);F在NaBH4作用下发生加成生成
(F);F在NaBH4作用下发生加成生成  (G)。
(G)。
(1) A为CH2=CH-CH=CH2,名称是1,3-丁二烯。答案为:1,3-丁二烯;
(2)②中,![]() 在NaOH醇溶液中消去生成
在NaOH醇溶液中消去生成![]() ,,化学方程式是
,,化学方程式是 +NaOH
+NaOH![]()
![]() +NaCl+H2O。答案为:
+NaCl+H2O。答案为: +NaOH
+NaOH![]()
![]() +NaCl+H2O;
+NaCl+H2O;
(3)③为![]() 与
与![]() 在加热条件下反应生成
在加热条件下反应生成![]() ,反应类型是加成反应。答案为:加成反应;
,反应类型是加成反应。答案为:加成反应;
(4)D为 ,官能团名称是碳碳双键,氯原子,酯基。答案为:碳碳双键,氯原子,酯基;
,官能团名称是碳碳双键,氯原子,酯基。答案为:碳碳双键,氯原子,酯基;
(5)a.反应⑥为 在NaBH4作用下生成
在NaBH4作用下生成 ,是还原反应,a正确
,是还原反应,a正确
b.F为 ,与
,与![]() 互为同分异构体,b正确;
互为同分异构体,b正确;
c. (G)在碱性条件下,只有-COOH与OH-反应,可以转变成
(G)在碱性条件下,只有-COOH与OH-反应,可以转变成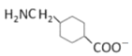 ,c正确;
,c正确;
d. (G)在酸性条件下,-NH2与H+发生反应,可以转变成
(G)在酸性条件下,-NH2与H+发生反应,可以转变成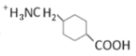 ,d正确;
,d正确;
故abcd都正确。答案为:abcd;
(6)a. 与硝基苯互为同系物,表明分子中含有苯环和硝基;
b.苯环上只有两个取代基,其中一个为-NO2,另一个为-CH2CH2CH3,或-CH(CH3)2;
c.苯环上一氯代物有2种,则两取代基位于苯环的对位;
由此可写出符合上述条件的同分异构体的结构简式为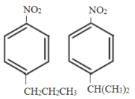 。答案为:
。答案为: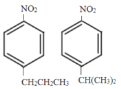 ;
;
(7) 依据信息A:CH3-CH=CH2![]() Br-CH2-CH=CH2,再将Br-CH2-CH=CH2转化为BrMg- CH2-CH=CH2,与HCHO发生加成反应,再水解、消去,即得目标有机物。合成路线为:CH3-CH=CH2
Br-CH2-CH=CH2,再将Br-CH2-CH=CH2转化为BrMg- CH2-CH=CH2,与HCHO发生加成反应,再水解、消去,即得目标有机物。合成路线为:CH3-CH=CH2![]() Br-CH2-CH=CH2
Br-CH2-CH=CH2![]()
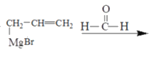
![]()
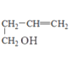
![]() CH2=CH-CH=CH2。答案为:
CH2=CH-CH=CH2。答案为:![]()
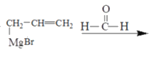
![]()
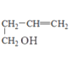
![]() CH2=CH-CH=CH2。
CH2=CH-CH=CH2。


科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.丙烯的结构简式为 CH3CHCH2
B.结构为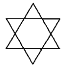 的有机物的分子式为 C12H12
的有机物的分子式为 C12H12
C.分子式为 C4H9Cl 的同分异构体共有 5 种
D.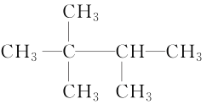 与(CH3)3CCH(CH3)2 不是同一物质
与(CH3)3CCH(CH3)2 不是同一物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )

A.氢氧化钠的物质的量浓度为1 mol·L-1
B.曲线b是氢氧化钠滴定盐酸的滴定曲线
C.P点时反应恰好完全,溶液呈中性
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改革开放四十年来,我国在很多领域取得了举世瞩目的成就,下列工程使用的部分材料如下所示,其中属于有机高分子的是
A.  港珠澳大桥桥墩——混凝土
港珠澳大桥桥墩——混凝土
B.  “人造太阳”核聚变实验装置——钨合金
“人造太阳”核聚变实验装置——钨合金
C.  高铁轨道与地基之间填隙减震——聚氨酯
高铁轨道与地基之间填隙减震——聚氨酯
D.  “玉兔”月球车太阳能电池帆板——硅
“玉兔”月球车太阳能电池帆板——硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种极易溶于水且几乎不与冷水反应的黄绿色气体(沸点11℃),实验室制备纯净ClO2溶液的装置如图所示:

已知下列反应:NaClO3+HCl→NaCl+ClO2+Cl2+H2O;NaClO2+HCl→NaCl+ClO2+H2O;NaClO2+Cl2→NaCl+ClO2(均未配平)。下列说法正确的是
A.a中通入的N2可用CO2或SO2代替B.b中NaClO2可用饱和食盐水代替
C.c中广口瓶最好放在冰水浴中冷却D.d中吸收尾气后只生成一种溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.10 mol/L的NaOH溶液分别滴定体积均为20.00mL、浓度均为0.050 mol/L的盐酸、磷酸及谷氨酸(H2G),滴定曲线如图所示:
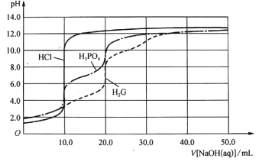
下列说法正确的是
A.滴定盐酸时,用甲基橙作指示剂比用酚酞更好
B.H3PO4与H2G的第一电离平衡常数K1的数量级不同
C.用酚酞作指示剂滴定磷酸到终点时,溶液中的溶质为Na2HPO4
D.NaH2PO4溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、硼的合金及其化合物用途非常广泛。回答下列问题:
(1)基态Cr原子核外电子的排布式是[Ar] ___;基态硼原子中占据最高能级的电子云轮廓图为____形。
(2)铬的配合物有氯化三乙二胺合铬![]() 和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
①配体en表示NH2CH2CH2NH2,其中碳原子的杂化方式是____。
②NH4+空间构型为____,与其键合方式相同且空间构型也相同的含硼阴离子是_____ 。
③C、N、O三种元素第一电离能由小到大的顺序为 ___;![]() 含有三个五元环,画出其结构:_______________。
含有三个五元环,画出其结构:_______________。
(3)硼酸[H3BO3或B(OH)3]为白色片状晶体,熔点为171℃。下列说法正确的是___填字母)。
A.硼酸分子中,∠OBO的键角为120° B.硼酸分子中存在σ键和π键
C.硼酸晶体中,片层内存在氢键 D.硼酸晶体中,片层间存在共价键
(4)2019年11月《EurekAlert》报道了铬基氮化物超导体,其晶胞结构如图所示:

由三种元素Pr(镨)、Cr、N构成的该化合物的化学式为 ___。
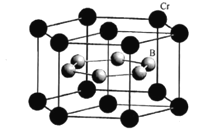
(5)CrB2的晶胞结构如图所示,六棱柱底边边长为acm,高为c cm,阿伏加德罗常数的值为NA,CrB2的密度为 ___gcm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定意义重大,氮肥的使用大面积提高了粮食产量。人工固氮最有效的方法是合成氦,一种工业合成氨的简易流程如图所示(净化、后期处理等流程未列出):

回答下列问题:
Ⅰ.步骤A制氢气的原理之一是CH4(g)+2H2O(g)CO2(g)+4H2(g) H=a kJ/mol
(1)已知:H2、CH4的燃烧热分别为285.8kJ/mol、890.31k/mol;H2O(g)H2O(l) H=-44kJ/mol则a=____kJ/mol。
(2)在密闭容器中,既能加快反应速率,又一定能提高平衡体系中H2体积分数的措施是_____(填序号)。
a.加入催化剂 b.升高温度 c.降低压强 d.增大c(H2O)
Ⅱ.步骤B完成了原料气准备后,通过步骤C合成氨,其原理为N2(g)+3H2(g)![]() 2NH3(g) H=-92.4kJ/mol。
2NH3(g) H=-92.4kJ/mol。
(3)若T℃下,向一个容积为2L的真空密闭容器中(有催化剂)通入lmol N2、3mol H2,1分钟后达到化学平衡状态,测得容器内的压强是开始时的0.8倍。则:
①下列叙述可说明该反应已经达到化学平衡状态的是______(填序号)。
a.3v(H2)正=2v(NH3)逆 b.混合气体的平均相对分子质量不再发生改变
c.混合气体的密度不再发生改变 d. 1个N≡N键断裂的同时有3个H—H键生成
②t分钟内v(H2)=_______。
③T℃下该反应的K=___________(列出计算式即可)。
④一定条件下,向体积相同的甲(含催化剂)、乙两个容器中分别充入等物质的量的N2和等物质的量的H2进行合成氨反应,均反应1小时、测得N2的转化率随温度变化如图所示,a、b、c三点中达到化学平衡状态的点有_________,乙装置中N2转化率随着温度的升高先升后降的原因可能是______。

(4)我国科学家成功研制出一种高效电催化固氮催化剂Mo2N,其固氮原理如图所示,该装置中,阴极上的电极反应式为______。
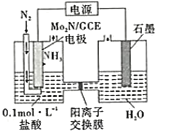
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.6g铁粉投入到盛有100mL2molL-1稀硫酸的烧杯中,2min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是( )
A. v(H2SO4)=0.5mol (Lmin)-1B. v(H2SO4)=1 mol (Lmin)-1
C. v(Fe)=0.5mol (Lmin)-1D. v(FeSO4)=1mol (Lmin)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com